题目内容
已知可逆反应CO(g)+H2O(g)?CO2(g)+H2(g),达到平衡时,K=
,K是常数,只与温度有关,与浓度无关.830K时,若起始时:c(CO)=2mol/L,c(H2O)=3mol/L,平衡时CO的转化率为60%,水的转化率为 ;K值为 .
| c(CO2)×c(H2) |
| c(CO)×c(H2O) |
考点:化学平衡的计算
专题:
分析:依据化学平衡三段式列式计算,平衡时CO的转化率为60%,转化的一氧化碳浓度=60%×2mol/L=1.2mol/L
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol/L) 2 3 0 0
变化量(mol/L) 1.2 1.2 1.2 1.2
平衡量(mol/L) 0.8 1.8 1.2 1.2
转化率=
×100%
平衡常数K=
.
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol/L) 2 3 0 0
变化量(mol/L) 1.2 1.2 1.2 1.2
平衡量(mol/L) 0.8 1.8 1.2 1.2
转化率=
| 消耗量 |
| 起始量 |
平衡常数K=
| c(CO2)×c(H2) |
| c(CO)×c(H2O) |
解答:
解:平衡时CO的转化率为60%,转化的一氧化碳浓度=60%×2mol/L=1.2mol/L
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol/L) 2 3 0 0
变化量(mol/L) 1.2 1.2 1.2 1.2
平衡量(mol/L) 0.8 1.8 1.2 1.2
水的转化率=
×100%=
×100%=40%
平衡常数K=
=
=1
故答案为:40%;1.
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol/L) 2 3 0 0
变化量(mol/L) 1.2 1.2 1.2 1.2
平衡量(mol/L) 0.8 1.8 1.2 1.2
水的转化率=
| 消耗量 |
| 起始量 |
| 1.2mol/L |
| 3mol/L |
平衡常数K=
| c(CO2)×c(H2) |
| c(CO)×c(H2O) |
| 1.2×1.2 |
| 0.8×1.8 |
故答案为:40%;1.
点评:本题考查了化学平衡的计算分析应用,掌握方法和平衡常数概念计算是关键,题目较简单.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目
在容积相等的甲乙两个密闭容器中,分别都充入2mol SO2和1mol O2,使它们在相同温度下发生反应2SO2(g)+O2(g)?2SO3(g).设在反应过程中,甲容器保持体积不变,乙容器保持压强不变,达到平衡后,如甲容器中SO2的转化率为25%,则乙容器中SO2的转化率应当是( )
| A、25% | B、<25% |
| C、>25% | D、无法判断 |
有机物CH3-CH═CH-Cl能发生( )
①取代反应 ②加成反应 ③消去反应 ④使溴水褪色 ⑤使KMnO4酸性溶液褪色 ⑥与AgNO3溶液生成白色沉淀 ⑦聚合反应.
①取代反应 ②加成反应 ③消去反应 ④使溴水褪色 ⑤使KMnO4酸性溶液褪色 ⑥与AgNO3溶液生成白色沉淀 ⑦聚合反应.
| A、以上反应均可发生 |
| B、只有⑥不能发生 |
| C、只有⑦不能发生 |
| D、只有②不能发生 |
丙烷的燃烧热为△H=-a kJ/mol,有以下反应:
①C3H8(g)=C3H6(g)+H2(g)△H=+b kJ/mol
②2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l)△H=-c kJ/mol
③2H2(g)+O2(g)=2H2O(l)△H=-d kJ/mol (b、c、d均为正值)则正确的( )
①C3H8(g)=C3H6(g)+H2(g)△H=+b kJ/mol
②2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l)△H=-c kJ/mol
③2H2(g)+O2(g)=2H2O(l)△H=-d kJ/mol (b、c、d均为正值)则正确的( )
| A、2a=c-d-2b |
| B、a=c-d-2b |
| C、2a=c+d-2b |
| D、a=c+d-b/2 |
某无色透明的溶液,能使石蕊变红,也能使酚酞变红的溶液中都能大量共存的是( )
| A、Fe3+ K+ SO42- NO3- |
| B、Mg2+NH4+ SO42- Cl- |
| C、Na+ K+ SO42- NO3- |
| D、K+ Na+ MnO4- SO42- |
通常情况下,下列物质可用铝制槽车装运的是( )
| A、稀盐酸 | B、浓硫酸 |
| C、稀硝酸 | D、浓氢氧化钠溶液 |
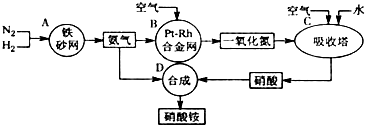
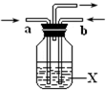 A、B、C、D、E、F、G、H是相对分子质量依次增大的气体,它们均由短周期元素组成,具有如下性质:
A、B、C、D、E、F、G、H是相对分子质量依次增大的气体,它们均由短周期元素组成,具有如下性质: