题目内容
丙烷的燃烧热为△H=-a kJ/mol,有以下反应:
①C3H8(g)=C3H6(g)+H2(g)△H=+b kJ/mol
②2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l)△H=-c kJ/mol
③2H2(g)+O2(g)=2H2O(l)△H=-d kJ/mol (b、c、d均为正值)则正确的( )
①C3H8(g)=C3H6(g)+H2(g)△H=+b kJ/mol
②2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l)△H=-c kJ/mol
③2H2(g)+O2(g)=2H2O(l)△H=-d kJ/mol (b、c、d均为正值)则正确的( )
| A、2a=c-d-2b |
| B、a=c-d-2b |
| C、2a=c+d-2b |
| D、a=c+d-b/2 |
考点:用盖斯定律进行有关反应热的计算
专题:
分析:由①C3H8(g)=C3H6(g)+H2(g)△H=+b kJ?mol-1
②2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l)△H=-c kJ?mol-1
③2H2(g)+O2(g)=2H2O(l)△H=-d kJ?mol-1
依据盖斯定律①×2+②+③得到2C3H8(g)+10O2(g)=6CO2(g)+8H2O(l)△H=(2b-c-d)KJ/mol;
再根据燃烧热为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-a=-
(2b-c-d)KJ/mol;
得到a=-
(2b-c-d),2a=c+d-2b.
②2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l)△H=-c kJ?mol-1
③2H2(g)+O2(g)=2H2O(l)△H=-d kJ?mol-1
依据盖斯定律①×2+②+③得到2C3H8(g)+10O2(g)=6CO2(g)+8H2O(l)△H=(2b-c-d)KJ/mol;
再根据燃烧热为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-a=-
| 1 |
| 2 |
得到a=-
| 1 |
| 2 |
解答:
解:①C3H8(g)=C3H6(g)+H2(g)△H=+b kJ?mol-1
②2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l)△H=-c kJ?mol-1
③2H2(g)+O2(g)=2H2O(l)△H=-d kJ?mol-1
依据盖斯定律①×2+②+③得到2C3H8(g)+10O2(g)=6CO2(g)+8H2O(l)△H=(2b-c-d)KJ/mol;
燃烧热为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-a=-
(2b-c-d)KJ/mol;
得到a=-
(2b-c-d),2a=c+d-2b;
故选C.
②2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l)△H=-c kJ?mol-1
③2H2(g)+O2(g)=2H2O(l)△H=-d kJ?mol-1
依据盖斯定律①×2+②+③得到2C3H8(g)+10O2(g)=6CO2(g)+8H2O(l)△H=(2b-c-d)KJ/mol;
燃烧热为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-a=-
| 1 |
| 2 |
得到a=-
| 1 |
| 2 |
故选C.
点评:本题考查了热化学方程式的计算,盖斯定律应用,燃烧热概念的计算分析应用,题目难度中等.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目
工业生产中物质的循环利用有多种模式.例如:

表述不正确的是( )

表述不正确的是( )
| A、若图I为合成氨,则其中N2、H2可循环使用 |
| B、若图I为合成SO3,则其中SO2、O2可循环使用 |
| C、若图Ⅱ为电解熔融MgCl2得到镁,则其中HCl可循环使用 |
| D、若图Ⅲ为氨氧化法制硝酸,则其中NO2可循环使用 |
从柑桔中炼制出有机物  ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )
 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )| A、分子式为C10H16 |
| B、常温下为液态,难溶于水 |
| C、属于芳香烃 |
| D、1mol该物质与1molHCl加成所得产物有四种 |
下列实验可达到实验目的是( )
A、将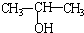 与NaOH的醇溶液共热制备CH3-CH═CH2 与NaOH的醇溶液共热制备CH3-CH═CH2 |
B、乙酰水杨酸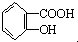 与适量NaOH溶液反应制备 与适量NaOH溶液反应制备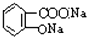 |
| C、向CH3CH2Br中滴入AgNO3溶液以检验溴元素 |
| D、甲苯在溴化铁催化作用下与液溴反应生成2,4,6-三溴甲苯 |
在某容器中,C+H2O(g)?CO+H2反应达到平衡,在温度、体积不变的情况下,向容器中充入一定量H2,当建立新平衡时( )
| A、CO、H2的浓度都比原平衡时的要小 |
| B、CO、H2的浓度都比原平衡时的要大 |
| C、H2、H2O(g)的浓度都比原平衡时的要大 |
| D、CO、H2O(g)的浓度都比原平衡时的要大 |
下列说法正确的是( )
| A、一定温度下,当弱酸的浓度相同时,电离常数越大,酸性越强 |
| B、合成氨的反应,正反应的平衡常数和逆反应的平衡常数相同 |
| C、实验测定酸碱滴定曲线时,要保证整个过程测试和记录pH的间隔相同 |
| D、pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
室温下,在pH=12的某溶液中,由水电离的[OH-]可能为( )
| A、1.0×10-7mol?L-1 |
| B、1.0×10-6mol?L-1 |
| C、1.0×10-12mol?L-1 |
| D、1.0×10-14mol?L-1 |