题目内容
 A、B、C、D、E、F、G、H是相对分子质量依次增大的气体,它们均由短周期元素组成,具有如下性质:
A、B、C、D、E、F、G、H是相对分子质量依次增大的气体,它们均由短周期元素组成,具有如下性质:①B能使湿润的红色石蕊试纸变蓝,A、C、D不能使湿润的石蕊试纸变色,E、F、G均可使湿润的蓝色石蕊试纸变红;
②F呈红棕色;
③G和H均能使品红褪色,A在H中安静燃烧并伴有产生苍白色火焰;
④C在D中完全燃烧生成E和H2O,同时放出大量热,工业上可利用该反应焊接或切割金属;
请回答下列问题:
(1)写出实验室制取B的化学方程式
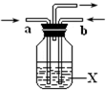
(2)若从a口通入气体G,从b口通入气体F,洗气瓶中装有氯化钡溶液,观察到的现象是
(3)已知:E(g)+3A(g)?CH3OH(l)+H2O(l)△H=-53.66kJ/mol2CH3OH(l)?CH3OCH3(g)+H2O(l)△H=-23.4kJ/mol写出E有催化剂时与A合成二甲醚(CH3OCH3)的热化学方程式
(4)气体C能使硫酸酸化的高锰酸钾溶液褪色,产物之一是E,该反应的化学方程式为
考点:几组未知物的检验
专题:物质检验鉴别题
分析:A、B、C、D、E、F、G、H是相对分子质量依次增大的气体,它们均由短周期元素组成,具有如下性质:
①B能使湿润的红色石蕊试纸变蓝,则B为NH3,A、C、D不能使湿润的石蕊试纸变色,三种气体既不显酸性也不显碱性,E、F、G均可使湿润的蓝色石蕊试纸变红,均表现酸性;
②F呈红棕色,则F为NO2;
③G和H均能使品红褪色,结合相对分子质量可知,G为SO2、H为Cl2;A在H中安静燃烧并伴有产生苍白色火焰,则A为H2;
④C在D中完全燃烧生成E和H2O,同时放出大量热,工业上可利用该反应焊接或切割金属,结合①可知,该反应为乙炔在氧气中燃烧得到CO2与水,C为C2H2、D为O2、E为CO2,据此解答.
①B能使湿润的红色石蕊试纸变蓝,则B为NH3,A、C、D不能使湿润的石蕊试纸变色,三种气体既不显酸性也不显碱性,E、F、G均可使湿润的蓝色石蕊试纸变红,均表现酸性;
②F呈红棕色,则F为NO2;
③G和H均能使品红褪色,结合相对分子质量可知,G为SO2、H为Cl2;A在H中安静燃烧并伴有产生苍白色火焰,则A为H2;
④C在D中完全燃烧生成E和H2O,同时放出大量热,工业上可利用该反应焊接或切割金属,结合①可知,该反应为乙炔在氧气中燃烧得到CO2与水,C为C2H2、D为O2、E为CO2,据此解答.
解答:
解:A、B、C、D、E、F、G、H是相对分子质量依次增大的气体,它们均由短周期元素组成,具有如下性质:
①B能使湿润的红色石蕊试纸变蓝,则B为NH3,A、C、D不能使湿润的石蕊试纸变色,三种气体既不显酸性也不显碱性,E、F、G均可使湿润的蓝色石蕊试纸变红,均表现酸性;
②F呈红棕色,则F为NO2;
③G和H均能使品红褪色,结合相对分子质量可知,G为SO2、H为Cl2;A在H中安静燃烧并伴有产生苍白色火焰,则A为H2;
④C在D中完全燃烧生成E和H2O,同时放出大量热,工业上可利用该反应焊接或切割金属,结合①可知,该反应为乙炔在氧气中燃烧得到CO2与水,C为C2H2、D为O2、E为CO2,
(1)实验室制取NH3的化学方程式为2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑;
(2)若从a口通入气体SO2,从b口通入气体NO2,二氧化氮与水反应得到硝酸与NO,硝酸能将亚硫酸氧化为硫酸,被还原为NO,进一步反应得到硫酸钡,NO与空气中氧气反应得到二氧化氮,观察到的现象是:有白色沉淀生成,溶液上方无色气体变为红棕色,
故答案为:有白色沉淀生成,溶液上方无色气体变为红棕色;H2O+SO2+NO2+Ba2+=BaSO4↓+NO↑+2H+、2NO+O2=NO2;
(3)已知:①CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-53.66kJ/mol
②2CH3OH(l)?CH3OCH3(g)+H2O(l)△H=-23.4kJ/mol
则反应2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(l)可以是①×2+②得到,所以△H=(-53.66kJ/mol)×2-23.4kJ/mol=-130.72kJ/mol,
即2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(l)△H=-130.72kJ/mol,
故答案为:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(l)△H=-130.72kJ/mol;
(4)气体C2H2具有还原性,能使用硫酸酸化的KMnO4溶液褪色,产物为CO2、MnSO4和水,该反应的化学方程式为C2H2+2KMnO4+3H2SO4=2CO2+K2SO4+2MnSO4+4H2O,
故答案为:C2H2+2KMnO4+3H2SO4=2CO2+K2SO4+2MnSO4+4H2O.
①B能使湿润的红色石蕊试纸变蓝,则B为NH3,A、C、D不能使湿润的石蕊试纸变色,三种气体既不显酸性也不显碱性,E、F、G均可使湿润的蓝色石蕊试纸变红,均表现酸性;
②F呈红棕色,则F为NO2;
③G和H均能使品红褪色,结合相对分子质量可知,G为SO2、H为Cl2;A在H中安静燃烧并伴有产生苍白色火焰,则A为H2;
④C在D中完全燃烧生成E和H2O,同时放出大量热,工业上可利用该反应焊接或切割金属,结合①可知,该反应为乙炔在氧气中燃烧得到CO2与水,C为C2H2、D为O2、E为CO2,
(1)实验室制取NH3的化学方程式为2NH4Cl+Ca(OH)2
| ||
| ||
(2)若从a口通入气体SO2,从b口通入气体NO2,二氧化氮与水反应得到硝酸与NO,硝酸能将亚硫酸氧化为硫酸,被还原为NO,进一步反应得到硫酸钡,NO与空气中氧气反应得到二氧化氮,观察到的现象是:有白色沉淀生成,溶液上方无色气体变为红棕色,
故答案为:有白色沉淀生成,溶液上方无色气体变为红棕色;H2O+SO2+NO2+Ba2+=BaSO4↓+NO↑+2H+、2NO+O2=NO2;
(3)已知:①CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-53.66kJ/mol
②2CH3OH(l)?CH3OCH3(g)+H2O(l)△H=-23.4kJ/mol
则反应2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(l)可以是①×2+②得到,所以△H=(-53.66kJ/mol)×2-23.4kJ/mol=-130.72kJ/mol,
即2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(l)△H=-130.72kJ/mol,
故答案为:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(l)△H=-130.72kJ/mol;
(4)气体C2H2具有还原性,能使用硫酸酸化的KMnO4溶液褪色,产物为CO2、MnSO4和水,该反应的化学方程式为C2H2+2KMnO4+3H2SO4=2CO2+K2SO4+2MnSO4+4H2O,
故答案为:C2H2+2KMnO4+3H2SO4=2CO2+K2SO4+2MnSO4+4H2O.
点评:本题考查无机物推断,物质特殊颜色、特殊性质等是推断的关键,需要学生熟练掌握基础知识知识,难度中等.

练习册系列答案
相关题目
下列实验可达到实验目的是( )
A、将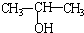 与NaOH的醇溶液共热制备CH3-CH═CH2 与NaOH的醇溶液共热制备CH3-CH═CH2 |
B、乙酰水杨酸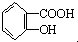 与适量NaOH溶液反应制备 与适量NaOH溶液反应制备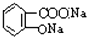 |
| C、向CH3CH2Br中滴入AgNO3溶液以检验溴元素 |
| D、甲苯在溴化铁催化作用下与液溴反应生成2,4,6-三溴甲苯 |
 某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如下图.材料1:NH3是强还原剂,能将某些金属氧化物还原为金属单质或低价态的氧化物.如:2NH3+3CuO
某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如下图.材料1:NH3是强还原剂,能将某些金属氧化物还原为金属单质或低价态的氧化物.如:2NH3+3CuO 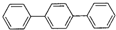 它的分子式为
它的分子式为