题目内容
在容积相等的甲乙两个密闭容器中,分别都充入2mol SO2和1mol O2,使它们在相同温度下发生反应2SO2(g)+O2(g)?2SO3(g).设在反应过程中,甲容器保持体积不变,乙容器保持压强不变,达到平衡后,如甲容器中SO2的转化率为25%,则乙容器中SO2的转化率应当是( )
| A、25% | B、<25% |
| C、>25% | D、无法判断 |
考点:化学平衡的计算
专题:
分析:在相同温度下发生反应2SO2+O2?2SO3,该反应为气体物质的量减小的反应,若甲容器保持体积不变,乙容器保持压强不变,则随着反应的进行,甲的压强逐渐减小,达平衡时,乙容器压强大于甲容器压强,根据压强对平衡移动的影响分析.
解答:
解:2SO2+O2?2SO3反应为气体物质的量减小的反应,
若甲容器保持体积不变,乙容器保持压强不变,则随着反应的进行,甲的压强逐渐减小,乙容器压强大于A容器压强,增大压强,平衡向正反应方向移动,
当甲中的SO2的转化率为25%时,则乙容器中SO2的转化率应是大于25%,
故选:C.
若甲容器保持体积不变,乙容器保持压强不变,则随着反应的进行,甲的压强逐渐减小,乙容器压强大于A容器压强,增大压强,平衡向正反应方向移动,
当甲中的SO2的转化率为25%时,则乙容器中SO2的转化率应是大于25%,
故选:C.
点评:本题考查化学平衡的影响因素,题目难度中等,注意根据反应方程式的特点把握压强对平衡移动的影响.

练习册系列答案
相关题目
标准状况下22.4LH2 和C2H4的混合气体在一定条件下反应,所得气态物质完全燃烧恢复至常温后放出736KJ热量,混合气体中H2和C2H4的物质的量之比应为[已知H2、C2H4、C2H6的燃烧热(单位:KJ/mol)分别是286、1411和1560]( )
| A、1:3 | B、2:3 |
| C、3:1 | D、3:2 |
固体粉末X中可能含有Fe、Fe2O3、K2SiO3、K2SO3、KAlO2、MgCl2、K2CO3中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如下:根据上述实验,以下说法正确的是( )


| A、气体A一定只是NO |
| B、由于在溶液A中加入BaCl2溶液有沉淀产生,因此可以判断溶液中含有K2SO3 |
| C、若向固体甲中加入足量浓盐酸,再加KSCN溶液,没有血红色,则证明原混合物中一定没有Fe2O3 |
| D、溶液甲中一定含有K2SiO3、可能含有KAlO2、MgCl2 |
从柑桔中炼制出有机物 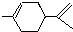 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )
 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )| A、分子式为C10H16 |
| B、常温下为液态,难溶于水 |
| C、属于芳香烃 |
| D、1mol该物质与1molHCl加成所得产物有四种 |
在某容器中,C+H2O(g)?CO+H2反应达到平衡,在温度、体积不变的情况下,向容器中充入一定量H2,当建立新平衡时( )
| A、CO、H2的浓度都比原平衡时的要小 |
| B、CO、H2的浓度都比原平衡时的要大 |
| C、H2、H2O(g)的浓度都比原平衡时的要大 |
| D、CO、H2O(g)的浓度都比原平衡时的要大 |
下列说法不正确的是( )
| A、苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 |
| B、用溴水即可鉴别苯酚溶液、2,4-已二烯和甲苯 |
| C、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| D、分子式为C4H10O并能与金属钠反应放出氢气的有机化合物有4种 |
 如图是研究铜与浓硫酸的反应装置:
如图是研究铜与浓硫酸的反应装置: