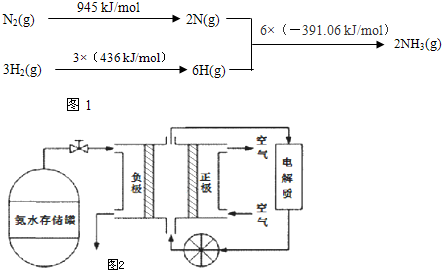
题目内容
有机物CH3-CH═CH-Cl能发生( )
①取代反应 ②加成反应 ③消去反应 ④使溴水褪色 ⑤使KMnO4酸性溶液褪色 ⑥与AgNO3溶液生成白色沉淀 ⑦聚合反应.
①取代反应 ②加成反应 ③消去反应 ④使溴水褪色 ⑤使KMnO4酸性溶液褪色 ⑥与AgNO3溶液生成白色沉淀 ⑦聚合反应.
| A、以上反应均可发生 |
| B、只有⑥不能发生 |
| C、只有⑦不能发生 |
| D、只有②不能发生 |
考点:有机物的结构和性质
专题:
分析:由结构简式可知,分子中含双键、-Cl,结合烯烃及卤代烃的性质来解答.
解答:
解:含双键,可发生加成反应、与溴水发生加成反应使其褪色、与高锰酸钾发生氧化反应使其褪色、发生聚合反应;
含-Cl,可发生消去反应、取代反应,
则一定不能发生与AgNO3溶液生成白色沉淀,
故选B.
含-Cl,可发生消去反应、取代反应,
则一定不能发生与AgNO3溶液生成白色沉淀,
故选B.
点评:本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重烯烃和卤代烃性质及反应类型的考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
下列有关工业生产的叙述正确的是( )
| A、合成氨生产过程中升高温度可加快反应速率,缩短生产周期,故温度越高越好 |
| B、硫酸工业中,使用催化剂是为了提高SO2转化为SO3的转化率 |
| C、电解精炼铜时,精铜作阴极 |
| D、电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |
在一定条件下,反应CO+NO2?CO2+NO 达到平衡后,降低温度,混合气体的颜色变浅.下列判断正确的是( )
| A、正反应为吸热反应 |
| B、正反应为放热反应 |
| C、CO的浓度增大 |
| D、各物质的浓度不变 |
下列实验可达到实验目的是( )
A、将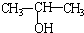 与NaOH的醇溶液共热制备CH3-CH═CH2 与NaOH的醇溶液共热制备CH3-CH═CH2 |
B、乙酰水杨酸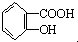 与适量NaOH溶液反应制备 与适量NaOH溶液反应制备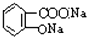 |
| C、向CH3CH2Br中滴入AgNO3溶液以检验溴元素 |
| D、甲苯在溴化铁催化作用下与液溴反应生成2,4,6-三溴甲苯 |
下列各组离子中,在溶液中能大量共存的是( )
| A、HCO3-、Cl-、Na+、H+ |
| B、Al3+、K+、OH-、SO42- |
| C、Fe2+、NO3-、SO42-、H+ |
| D、K+、Al3+、SO42-、NO3- |
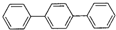 它的分子式为
它的分子式为