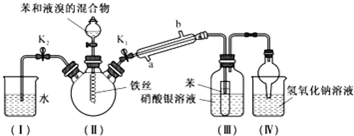
题目内容
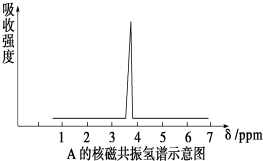
19.(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72L(标准状况下).有机物A的实验式为C2H6O;(2)质谱仪测定有机化合物A的相对分子质量为46,A的核磁共振氢谱如图所示,则A的结构简式为CH3-O-CH3;
(3)A的同分异构体B属于醇,则23g B 与足量的金属钠反应产生的气体在在标准状况下的体积为5.6L.
分析 (1)根据元素守恒可判断有机化合物中一定含有C和H两种元素,根据生成8.8g的二氧化碳中C元素质量即为化合物中所含C元素质量、生成5.4g 的水中H元素质量即为化合物中所含H元素质量,对氧元素的确定要根据二氧化碳和水中的氧元素质量之和与氧气中氧元素的质量来分析,若前者大,则有机化合物有氧元素,两者相等,则有机化合物没有有氧元素,然后求出各自的物质的量,根据各元素的物质的量之比可推测实验式(最简式);
(2)根据有机物的最简式和相对分子质量求出分子式,然后根据氢原子的种类写出结构简式;
(3)A的同分异构体B属于醇,应为CH3CH2OH,结合对应的方程式计算生成氢气的体积.
解答 解:(1)根据质量守恒定律可知,化合物中所含C元素质量为:8.8g×$\frac{12}{44}$=2.4g,所含H元素质量为:5.4g×$\frac{2}{18}$=0.6g,二氧化碳和水中的氧元素质量之和为 (8.8g-2.4g)+(5.4g-0.6g)=11.2g,而氧气的质量为$\frac{6.72L}{22.4L/mol}$×32g/mol=9.6g,所以有机物中氧元素质量为11.2g-9.6g=1.6g,
n(C):n(H):n(O)=$\frac{2.4}{12}$:$\frac{0.6}{1}$:$\frac{1.6}{16}$=2:6:1,所以化合物的实验式(最简式)是C2H6O,
故答案为:C2H6O;
(2)因化合物的实验式(最简式)是C2H6O,所以分子式为(C2H6O)n,而有机化合物的相对分子质量为46,所以n=1,则分子式为:C2H6O,由核磁共振氢谱示意图可知化合物中有1种氢原子,结构简式为CH3-O-CH3,故答案为:CH3-O-CH3;
(3)A的同分异构体B属于醇,应为CH3CH2OH,n(CH3CH2OH)=$\frac{23g}{46g/mol}$=0.5mol,生成氢气的关系式为CH3CH2OH~H2,可生成0.25mol气氢气,体积为0.25mol×22.4L/mol=5.6L.
故答案为:5.6L.
点评 本题考查有机物的分子式及结构的确定,为高频考点,涉及实验式的确定、核磁共振氢谱等知识,把握分子式确定及结构确定的方法为解答的关键,侧重分析与推断能力的考查,题目难度不大.

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案| A. | 稀H2SO4 | B. | 浓H2SO4 | C. | 浓HCl | D. | 浓CuSO4溶液 |
| A. | (CN)2+H2O?HCN+HCNO | |
| B. | (SCN)2+2Cu$\frac{\underline{\;\;△\;\;}}{\;}$ 2CuSCN | |
| C. | (OCN)2+2NaOH═NaOCN+NaOCNO+H2O | |
| D. | MnO2+4HSCN(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ (SCN)2↑+Mn(SCN)2+2H2O |
| A. | 水煤气 漂白粉 | B. | 盐酸 硫酸钡 | ||
| C. | 硫酸铜晶体 铝热剂 | D. | 玻璃 含铁70%的氧化铁 |
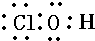 ,则1mol该物质所含有的电子的物质的量是( )
,则1mol该物质所含有的电子的物质的量是( )| A. | 14mol | B. | 15mol | C. | 26mol | D. | 27mol |
| A. | 先加BaCl2溶液,过滤后在滤液中再加AgNO3溶液 | |
| B. | 先加足量的Ba(NO3)2溶液,过滤后在滤液中再加AgNO3溶液和硝酸溶液 | |
| C. | 先加AgNO3溶液,过滤后,在沉淀中再加稀硝酸 | |
| D. | 先加足量的Ba(OH)2溶液,过滤后在滤液中再加AgNO3溶液 |