题目内容
2.常温下由CO、H2和O2组成的混合气体,测得该混合气体对氢气的相对密度为14,则原混合气体中CO、H2和O2的体积比为( )| A. | 1:2:15 | B. | 1:1:13 | C. | 1:2:13 | D. | 2:13:5 |
分析 常温下由CO、H2和O2组成的混合气体,测得该混合气体对氢气的相对密度为14,可知混合气体的平均相对分子质量为:2×14=28,而CO的相对分子质量也为28,则H2和O2的平均相对分子质量为28,以此解答该题.
解答 解:常温下由CO、H2和O2组成的混合气体,测得该混合气体对氢气的相对密度为14,可知混合气体的平均相对分子质量=2×14=28,由于CO的相对分子质量为28,则H2和O2的平均相对分子质量为28即可,CO的体积为任意体积,
设混合气体中H2和O2的物质的量分别为x、y,则$\frac{2x+32y}{x+y}$=28,整理可得:x:y=2:13,
相同条件下气体体积之比等于物质的量之比,则混合气体中H2和O2的体积之比为2:13,CO的体积为任意体积,只有C符合,
故选C.
点评 本题考查物质的量的计算,题目难度不大,根据相同条件下气体的密度之比得出混合气体的平均分子量为解答关键,注意掌握平均分子量的含义及表达式,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
相关题目
13.某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味无毒的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀的物质的量与加入NaOH的物质的量之间的关系如右图所示.则下列说法正确的是( )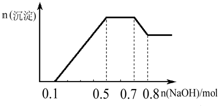

| A. | 溶液中的阳离子只有H+、Mg2+、Al3+ | |
| B. | 溶液中一定不含CO32-,一定含有SO42-和NO3- | |
| C. | 溶液中n(NH4+)=0.2 mol | |
| D. | 三种离子的物质的量之比n(H+):n(Al3+):n(Mg2+)=1:1:1 |
10.下列物质中存在顺反异构体的是( )
| A. | 2-氯丙烯 | B. | 1,2-二氯乙烯 | C. | 2-甲基-2-丁烯 | D. | 1-丁烯 |
7.下列检验Na2SO4溶液中是否含有Cl-的方法,正确的是( )
| A. | 先加BaCl2溶液,过滤后在滤液中再加AgNO3溶液 | |
| B. | 先加足量的Ba(NO3)2溶液,过滤后在滤液中再加AgNO3溶液和硝酸溶液 | |
| C. | 先加AgNO3溶液,过滤后,在沉淀中再加稀硝酸 | |
| D. | 先加足量的Ba(OH)2溶液,过滤后在滤液中再加AgNO3溶液 |
14.下列说法正确的是( )
| A. | 酸式盐的溶液一定显碱性 | |
| B. | 只要酸与碱的物质的量浓度和体积分别相等,它们反应后的溶液是中性的 | |
| C. | 纯水呈中性时因为水中c(H+)=c(OHˉ) | |
| D. | 碳酸溶液中氢离子的物质的量浓度是碳酸根离子物质的量浓度的2倍 |

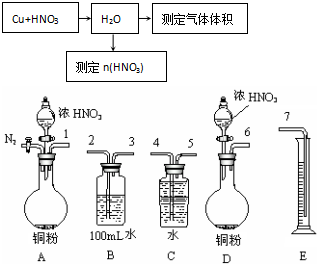
 .
.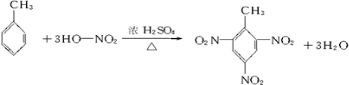 .
.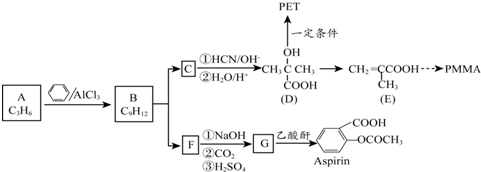
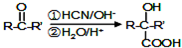
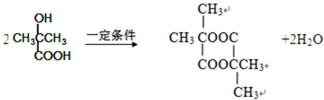 .1mol Aspirin分子与足量的NaOH反应的化学方程式是
.1mol Aspirin分子与足量的NaOH反应的化学方程式是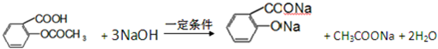 .
.