题目内容
4.三乙醇铝(AlC6H15O3)是酯化反应及聚合反应的催化剂,遇水分解生成氢氧化铝,可由无水乙醇与铝汞合金反应制备,下列有关叙述或表示正确的是( )| A. | 乙醇的结构式为C2H6O | |
| B. | 中子数为14的铝原子可表示为${\;}_{13}^{14}$Al | |
| C. | 铝汞合金的熔点比金属铝的高 | |
| D. | Al(OH)3的电离方程式为H++AlO2-+H2O?Al(OH)3?Al3++3OH- |
分析 A.用一条短线代表一对共用电子对所得到的式子为结构式;
B.左上角为质量数,等于质子数加中子数;
C.合金要比它的组成成分金属的硬度大,熔点低;
D.氢氧化铝属于两性氢氧化物,有两种电离方式.
解答 解:A.C2H6O为乙醇的分子式,乙醇中含有CH3CH2-和-OH,结构式为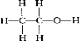 ,故A错误;
,故A错误;
B.中子数为14的铝原子:1327Al,故B错误;
C.铝汞合金的熔点比金属铝的低,故C错误;
D.氢氧化铝属于两性氢氧化物,有酸式电离和碱式电离两种电离方式,电离方程式为:Al(OH)3?Al3++3OH-?Al(OH)3 H++AlO2-+H2O,故D正确;
故选D.
点评 本题考查了化学用语的使用,涉及结构式、原子符号、合金的熔、电解质电离方程式书写,侧重考查学生对基础知识掌握的熟练程度,题目难度不大.

练习册系列答案
相关题目
20.下列对化学反应速率的叙述中错误的是( )
| A. | 化学反应速率是表示反应激烈程度的一个数据 | |
| B. | 反应速率是用单位时间内某反应物或生成物的浓度变化表示的 | |
| C. | 反应中不同物质单位时间内浓度变化来表示的同一个反应的速率,其数值可能不同 | |
| D. | 影响化学反应速率最大的因素是温度 |
1.用NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 常温下,23gNO2和N2O4的混合气体中含有的氮原子数为0.5NA | |
| C. | 标准状况下,22.4L空气含有NA个单质分子 | |
| D. | 标准状况下,22.4LSO3中含有的氧原子数为3NA |
18.亚硝酸(HNO2)参加反应时,既可作氧化剂,又可作还原剂.当它只作氧化剂时,可能生成的产物是( )
| A. | NO2 | B. | N2 | C. | HNO3 | D. | NO |
5.已知氢化钠(NaH)是一种离子化合物,其中钠是+1价,NaH与水反应放出H2(NaH+H2O→NaOH+H2).下列叙述中正确的是( )
| A. | NaH在水中显酸性 | |
| B. | NaH中氢离子的电子层排布与氦原子相同 | |
| C. | NaH在反应中表现氧化性 | |
| D. | NaH中氢离子可被氧化成氢气 |
9.某溶液中有NH4+、Fe3+、Fe2+ 和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中离子个数没有变化的离子是( )
| A. | NH4+ | B. | Fe3+ | C. | Fe2+ | D. | Al3+ |
16.常见物质的转化是化学学习的重要内容之一,下列各组物质的转化关系中不全部是通过一步反应完成的是( )
| A. | Na→NaOH→Na2CO3→NaCl | B. | Al→Al2O3→Al(OH)3→AlCl3 | ||
| C. | Fe→Fe(NO3)3→Fe(OH)3→Fe2O3 | D. | S→SO2→SO3→H2SO4 |
13.当一块冰融化成水,再转变为水蒸气时,一定( )
| A. | 先放出能量,再吸收能量 | B. | 先吸收能量,再放出能量 | ||
| C. | 只放出能量 | D. | 只吸收能量 |
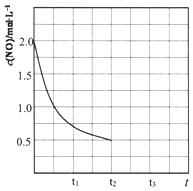 环境问题已成为人类共同关注的话题,燃煤废气、汽车尾气中的氮氧化物(NOx)、CO等有害气体,消除方法有多种.
环境问题已成为人类共同关注的话题,燃煤废气、汽车尾气中的氮氧化物(NOx)、CO等有害气体,消除方法有多种.