题目内容
18.亚硝酸(HNO2)参加反应时,既可作氧化剂,又可作还原剂.当它只作氧化剂时,可能生成的产物是( )| A. | NO2 | B. | N2 | C. | HNO3 | D. | NO |
分析 亚硝酸(HNO2)既可作氧化剂又可作还原剂,当它在反应中作氧化剂时,N元素的化合价应降低,以此来解答.
解答 解:亚硝酸中N元素的化合价为+3价,当它在反应中作氧化剂时,N元素的化合价应降低,
A.NO2中N元素的化合价为+4价,不可能为亚硝酸的还原产物,故A不选;
B.N2中N元素的化合价为0价,可能是亚硝酸的还原产物,故B选;
C.HNO3中N元素的化合价为+5价,不会是亚硝酸的还原产物,故C不选;
D.NO中N元素的化合价为+2价,可能为亚硝酸的还原产物,故D选;
故选BD.
点评 本题考查氧化还原反应,明确氧化剂中元素的化合价降低时解答本题的关键,题目难度不大,侧重于考查学生的分析能力和应用能力.

练习册系列答案
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
9.下列物质的水溶液中既能与H2S反应,又能与溴水反应的是( )
①硫化钠②硫酸铜③硝酸银④氢氧化钠⑤二氧化硫.
①硫化钠②硫酸铜③硝酸银④氢氧化钠⑤二氧化硫.
| A. | ①②③④⑤ | B. | ①③④⑤ | C. | ②③④ | D. | ④⑤ |
6.实验室常将浓盐酸与浓硫酸混合来制备HCl气体,下列与该原理无关的是( )
| A. | 浓硫酸具有脱水性 | |
| B. | 浓硫酸具有吸水性 | |
| C. | 浓硫酸稀释放热 | |
| D. | 气体在水中的及其随温度升高而减少 |
13.氢硫酸溶液与下列少量物质反应后,能使溶液酸性增强的是( )
①O2②I2③Pb(Ac)2④CuSO4.
①O2②I2③Pb(Ac)2④CuSO4.
| A. | ①③ | B. | ②④ | C. | ②③④ | D. | ① |
3.如图所示的是验证SO2性质的微型实验,a、b、c、d是浸有相关溶液的棉球.将硫酸滴入装有亚硫酸钠固体的培养皿.
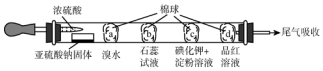
关于此实验的“现象”、“解释或结论”以及对应关系均正确的是( )

关于此实验的“现象”、“解释或结论”以及对应关系均正确的是( )
| 选项 | 现象 | 解释和结论 |
| A | a处橙色褪去 | 还原性:Br->SO2 |
| B | b处先变为红色后褪色 | SO2能与H2O反应,且有漂白性 |
| C | c处变为蓝色 | SO2具有一定的氧化性 |
| D | d处红色褪去 | SO2具有漂泊性 |
| A. | A | B. | B | C. | C | D. | D |
4.三乙醇铝(AlC6H15O3)是酯化反应及聚合反应的催化剂,遇水分解生成氢氧化铝,可由无水乙醇与铝汞合金反应制备,下列有关叙述或表示正确的是( )
| A. | 乙醇的结构式为C2H6O | |
| B. | 中子数为14的铝原子可表示为${\;}_{13}^{14}$Al | |
| C. | 铝汞合金的熔点比金属铝的高 | |
| D. | Al(OH)3的电离方程式为H++AlO2-+H2O?Al(OH)3?Al3++3OH- |
1.能形成简单阳离子的元素是( )
| A. | S | B. | Na | C. | Cl | D. | Ne |
2.下列对有机物结构或性质的描述,不正确的是( )
| A. | C4H9OH发生催化氧化反应,可生成3种有机产物 | |
| B. | 光照下,Cl2可在甲苯的苯环上发生取代反应 | |
| C. | 乙二醇和乙二酸可发生缩聚反应,生成高分子化合物 | |
| D. |  的分子式为C7H8O3 的分子式为C7H8O3 |