题目内容
9.某溶液中有NH4+、Fe3+、Fe2+ 和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中离子个数没有变化的离子是( )| A. | NH4+ | B. | Fe3+ | C. | Fe2+ | D. | Al3+ |
分析 加入过量的氢氧化钠溶液,微热并搅拌,离子均反应,只有铝离子转化为偏铝酸根离子,再加盐酸,又转化为铝离子,以此来解答.
解答 解:加入过量的氢氧化钠溶液,微热并搅拌,离子均反应,铝离子转化为偏铝酸根离子,再加盐酸,又转化为铝离子,则Al3+离子浓度不变,
而铵根离子与NaOH反应生成氨气,亚铁离子转化为沉淀后被氧化生成氢氧化铁,与盐酸反应生成铁离子,则铵根离子、亚铁离子浓度减小,Fe3+增大,
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的考查,注意亚铁发生的氧化还原反应,题目难度不大.

练习册系列答案
相关题目
5.某可逆反应达到化学平衡,当条件改变后平衡向正反应方向移动.则下列说法中正确的是( )
| A. | 反应物的浓度一定降低 | B. | 正反应速率一定大于逆应速率 | ||
| C. | 使用了合适的催化剂 | D. | 生成物的百分含量增大 |
6.实验室常将浓盐酸与浓硫酸混合来制备HCl气体,下列与该原理无关的是( )
| A. | 浓硫酸具有脱水性 | |
| B. | 浓硫酸具有吸水性 | |
| C. | 浓硫酸稀释放热 | |
| D. | 气体在水中的及其随温度升高而减少 |
3.如图所示的是验证SO2性质的微型实验,a、b、c、d是浸有相关溶液的棉球.将硫酸滴入装有亚硫酸钠固体的培养皿.
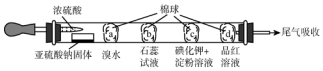
关于此实验的“现象”、“解释或结论”以及对应关系均正确的是( )

关于此实验的“现象”、“解释或结论”以及对应关系均正确的是( )
| 选项 | 现象 | 解释和结论 |
| A | a处橙色褪去 | 还原性:Br->SO2 |
| B | b处先变为红色后褪色 | SO2能与H2O反应,且有漂白性 |
| C | c处变为蓝色 | SO2具有一定的氧化性 |
| D | d处红色褪去 | SO2具有漂泊性 |
| A. | A | B. | B | C. | C | D. | D |
4.三乙醇铝(AlC6H15O3)是酯化反应及聚合反应的催化剂,遇水分解生成氢氧化铝,可由无水乙醇与铝汞合金反应制备,下列有关叙述或表示正确的是( )
| A. | 乙醇的结构式为C2H6O | |
| B. | 中子数为14的铝原子可表示为${\;}_{13}^{14}$Al | |
| C. | 铝汞合金的熔点比金属铝的高 | |
| D. | Al(OH)3的电离方程式为H++AlO2-+H2O?Al(OH)3?Al3++3OH- |
14.下列实验过程始终无明显现象的是( )
| A. | SO2通入BaCl2溶液中 | B. | CO2通入澄清石灰水中 | ||
| C. | NH3通入MgCl2溶液中 | D. | Cl2通入KI淀粉溶液中 |
1.能形成简单阳离子的元素是( )
| A. | S | B. | Na | C. | Cl | D. | Ne |
19.2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C的反应类型属于( )
| A. | 复分解反应 | B. | 置换反应 | C. | 化合反应 | D. | 分解反应 |