题目内容
14. 环境问题已成为人类共同关注的话题,燃煤废气、汽车尾气中的氮氧化物(NOx)、CO等有害气体,消除方法有多种.
环境问题已成为人类共同关注的话题,燃煤废气、汽车尾气中的氮氧化物(NOx)、CO等有害气体,消除方法有多种.(1)用稀土等催化剂能将汽车尾气中的CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染.已知:
①N2(g)+O2(g)═2NO(g)△H=180.5kJ/mol
②2C(s)+O2(g)═2CO(g)△H=-221kJ/mol
③C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJ/mol.
(2)①用甲烷催化还原氮的氧化物可消除氮氧化物的污染
CH4(g)+4NO(g)?2N2(g)+CO2(g)+2H2O(g)△H=QkJ•mol-1,写出上述反应的平衡常数表达式,已知该反应的平衡常数K随温度升高而减小,则Q< 0(填“>”或“<”或“=”).
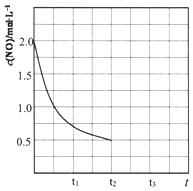
②某温度下,密闭容器中CH4与NO的起始浓度分别为1mol/L、2mol/L,其中c(NO)随时间变化如图所示,t2时达到平衡,保持温度不变在t2时将容器容积压缩到一半,请画出t2-t3c(CH4)随时间变化的曲线.
(3)①为提高反应:CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)中的转化率,可以采取在恒压条件下充入稀有气体,解释其原因恒压充入稀有气体后体积增大,有效气体的压强减少,平衡向正反应方向移动.
②电解吸收法处理氮氧化物废气的基本原理是用硝酸吸收氮氧化物生成NO2-,同时用石墨电极电解将NO2-转化成NO3-,电解条件下循环利用NO3-来处理氮氧化物.写出该法处理NO2总反应的化学方程式2NO2+2H2O$\frac{\underline{\;通电\;}}{\;}$2HNO3+H2↑.
分析 (1)根据方程式的加减得出NO与CO催化转化成N2和CO2的化学方程式,焓变相应的加减,从而得出其热化学反应方程式;
(2)①化学平衡常数等于生成浓的平衡浓度幂之积比上反应物浓度幂之积,该反应的平衡常数K随温度升高而减小,说明升高温度平衡逆向移动,说明逆反应是吸热反应;
②两边的化学计量数相等,所以将容器容积压缩到一半,相当于增大压强,因两边的计量数相等,所以平衡不移动,但CH4的浓度 是原来的2倍,由此分析作图;(3)①恒压充入稀有气体后体积增大,相当于减小压强,有效气体的压强减少,平衡向正反应方向移动;
②同时用石墨电极电解将NO2-转化成NO3-,中氮的化合价升高在阳极放电,所以阴极是溶液中的氢离子放电生成氢气,所以总的电极反应式为:2NO2+2H2O$\frac{\underline{\;通电\;}}{\;}$2HNO3+H2↑.
解答 解:(1)N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol①
2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol②
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol ③
方程式③×2-②-①得NO (g)+2CO(g)=N2(g)+2CO2(g)
所以△H=(-393.5kJ/mol)×2-(-221.0kJ/mol)-(+180.5kJ/mol)=-746.5 kJ/mol,
故答案为:2NO (g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ/mol;
(2)①化学平衡常数等于生成浓的平衡浓度幂之积比上反应物浓度幂之积,所以平衡常数K=$\frac{{c}^{2}({N}_{2})•c(C{O}_{2})•{c}^{2}({H}_{2}O)}{c(C{H}_{4})•{c}^{4}(NO)}$,该反应的平衡常数K随温度升高而减小,说明升高温度平衡逆向移动,说明逆反应是吸热反应,所以正反应是放热反应,故答案为:$\frac{{c}^{2}({N}_{2})•c(C{O}_{2})•{c}^{2}({H}_{2}O)}{c(C{H}_{4})•{c}^{4}(NO)}$;<;
②两边的化学计量数相等,所以将容器容积压缩到一半,相当于增大压强,因两边的计量数相等,所以平衡不移动,但CH4的浓度是原来的2倍,所以CH4的浓度为:(1-$\frac{1.5}{4}$)×2=1.25mol/L,由此作图为 ,故答案为:
,故答案为: ;
;
(3)①恒压充入稀有气体后体积增大,相当于减小压强,有效气体的压强减少,平衡向正反应方向移动,所以反应物的转化率增大,故答案为:恒压充入稀有气体后体积增大,有效气体的压强减少,平衡向正反应方向移动;
②同时用石墨电极电解将NO2-转化成NO3-,中氮的化合价升高在阳极放电,所以阴极是溶液中的氢离子放电生成氢气,所以总的电极反应式为:2NO2+2H2O$\frac{\underline{\;通电\;}}{\;}$2HNO3+H2↑,故答案为:2NO2+2H2O$\frac{\underline{\;通电\;}}{\;}$2HNO3+H2↑.
点评 本题考查化学平衡图象、化学平衡影响因素、化学平衡常数、化学平衡的计算、读图提取信息能力,难度中等,是对学生综合能力的考查,(2)为易错点,注意利用平衡常数的应用.

| A. | 乙醇的结构式为C2H6O | |
| B. | 中子数为14的铝原子可表示为${\;}_{13}^{14}$Al | |
| C. | 铝汞合金的熔点比金属铝的高 | |
| D. | Al(OH)3的电离方程式为H++AlO2-+H2O?Al(OH)3?Al3++3OH- |
| A. | 敞口久置,二者浓度均会变小 | B. | 常温下,均会使铝、铁钝化 | ||
| C. | 敞口久置,二者质量均会变大 | D. | 均具有强氧化性 |
| A. | C4H9OH发生催化氧化反应,可生成3种有机产物 | |
| B. | 光照下,Cl2可在甲苯的苯环上发生取代反应 | |
| C. | 乙二醇和乙二酸可发生缩聚反应,生成高分子化合物 | |
| D. |  的分子式为C7H8O3 的分子式为C7H8O3 |

| A. | 原子半径:W>X | |
| B. | 氢化物的热稳定性:Z>W | |
| C. | 元素Y与元素Z可形成化合物YZ2 | |
| D. | 由氢化物水溶液的酸性:W>Z可推知元素的非金属性W>Z |
| A. | 复分解反应 | B. | 置换反应 | C. | 化合反应 | D. | 分解反应 |
| A. | 焦炭炼铁、发酵粉烘焙糕点均会产生温室气体 | |
| B. | 浓硫酸滴在白纸上,白纸变黑,体现了浓硫酸的吸水性 | |
| C. | Cu与H2SO4在加热条件下发生反应,体现了浓H2SO4的还原性 | |
| D. | 雨水样品在空气中放置2小时后,测得pH变小,因为样品吸收了空气中的CO2 |
| A. | H2=2H++2e- | B. | H2+2OH--2e-═2H2O | ||
| C. | O2+2H2O+4e-═4OH- | D. | 4H++O2═2H2O-4e- |
| A. | 无色的溶液中:Fe3+、K+、ClO-、Cl- | |
| B. | pH=12的溶液中:NH4+、Na+、SO42-、Cl- | |
| C. | 含有大量Mg2+的溶液中:NH4+、Na+、SO42-、Cl- | |
| D. | c(H+)=0.1mol•L-1的溶液中:K+、I-、Cl-、NO3- |