题目内容
15.下列实验中金属或氧化物可以完全溶解的是( )| A. | 1mol铜片与含2molH2SO4的浓硫酸共热 | |
| B. | 1molMnO2粉末与含2molH2O2的溶液共热 | |
| C. | 常温下1mol铝片投入足量的浓硫酸中 | |
| D. | 常温下1mol铜片投入含4molHNO3的浓硝酸中 |
分析 A.金属铜和稀硫酸不反应,只能和浓硫酸反应;
B.反应中二氧化锰为催化剂,反应前后二氧化锰的量不变;
C.常温下,金属铝遇到浓硫酸发生钝化;
D.金属铜和浓硝酸以及稀硝酸均会发生反应.
解答 解:A.根据反应方程式可知64g即1mol铜片与含2 molH2SO4浓硫酸共热恰好反应,但是实际上随着反应的进行,浓硫酸会变稀,金属铜和稀硫酸不反应,所以金属铜会剩余,故A错误;
B.二氧化锰在反应中作催化剂,所以二氧化锰不会溶解,故C错误;
C.常温下,金属铝遇到浓硫酸发生钝化,所以常温下1 mol铝片投入足量的浓硫酸中金属会剩余,故C错误;
D.金属铜和浓硝酸以及稀硝酸均会发生反应,1mol铜片投入含4mol的浓硝酸中,会恰好反应,故D正确;
故选D.
点评 本题考查了常见元素单质及其化合物性质,题目难度不大,明确常见金属单质与酸的反应情况为解答关键,A为易错点,注意浓硫酸变成稀硫酸后反应停止,试题培养了学生的灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列各组混合物中,无论以何种比例混合,取1mol充分燃烧,耗氧量为定值的是( )
| A. | C2H6、C2H4O | B. | C2H4O、C2H4O2 | C. | C2H6O、C3H6O3 | D. | C3H8O3、C2H4O2 |
10.下列化合物在一定条件下能发生取代、还原、加成、消去四种反应的是( )
| A. | CH3-CHCl-CHO | B. | CH3-CHBr-CHBr-CH3 | ||
| C. | CH3-C≡C-CHO | D. | 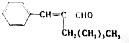 |
4.“高钙奶”中“钙”是指( )
| A. | 元素 | B. | 原子 | C. | 分子 | D. | 单质 |
11.下表列出了①~⑩九种元素在周期表的位置:
(1)写出①③④⑨的元素符号Na、Mg、Al、S.
(2)写出⑦单质的化学式Cl2.灼烧②的化合物,透过蓝色钴玻璃可看见火焰呈紫色,
(3)写出①单质与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(4)元素⑥的质子数为8,其原子核外有2个电子层.最外层电子数为6.
(5)元素④与⑥形成化合物的化学式为Al2O3,该化合物与盐酸反应的离子方程式为
Al2O3+6H+=2Al3++3H2O.
(6)单质⑦与石灰乳Ca(OH)2 反应可制得漂白粉,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.漂白粉的有效成分为Ca(ClO)2.
(7)元素⑩的气态氢化物的化学式为NH3,其水溶液呈碱性,实验室制取该物质的化学方程式为2NH4Cl+Ca(OH)2=CaCl2+NH3↑+2H2O.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑤ | ⑩ | ⑥ | |||||
| 3 | ① | ③ | ④ | ⑧ | ⑨ | ⑦ | ||
| 4 | ② |
(2)写出⑦单质的化学式Cl2.灼烧②的化合物,透过蓝色钴玻璃可看见火焰呈紫色,
(3)写出①单质与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(4)元素⑥的质子数为8,其原子核外有2个电子层.最外层电子数为6.
(5)元素④与⑥形成化合物的化学式为Al2O3,该化合物与盐酸反应的离子方程式为
Al2O3+6H+=2Al3++3H2O.
(6)单质⑦与石灰乳Ca(OH)2 反应可制得漂白粉,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.漂白粉的有效成分为Ca(ClO)2.
(7)元素⑩的气态氢化物的化学式为NH3,其水溶液呈碱性,实验室制取该物质的化学方程式为2NH4Cl+Ca(OH)2=CaCl2+NH3↑+2H2O.
8.恒温条件下,把NO2装入带活塞的密闭容器中,当反应2NO2(g)?N2O4(g)达到平衡后,慢慢压缩,下列叙述正确的是( )
| A. | 体积减半,则N2O4的浓度为原来的两倍 | |
| B. | 平衡向右移动,混合气体的颜色一定会变浅 | |
| C. | 体积减半,压强增大,但小于原来的2倍 | |
| D. | 平衡向右移动,但混合气体密度不变 |
 已知相邻的短周期元素A、B、C、D原子核外共有56个电子,在周期表中的位置如图所示.请画出C原子和A离子的结构示意图:
已知相邻的短周期元素A、B、C、D原子核外共有56个电子,在周期表中的位置如图所示.请画出C原子和A离子的结构示意图: 、
、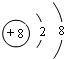 .
. .
.
 .
.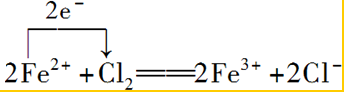 .
.