题目内容
Fe(s)+CO2(g)?FeO(s)+CO(g)△H=a kJ?mol-1,平衡常数为K测得在不同温度下,K值如下:
(1)若500℃时进行反应,CO2起始浓度为2mol?L-1,CO的平衡浓度为 .
(2)此反应焓变中的a 0(填大于、小于、等于).
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
(2)此反应焓变中的a
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)令平衡时CO的浓度为cmol/L,根据三段式用c表示出平衡时各成分的浓度,再根据平衡常数列方程计算;
(2)由表中数据可知,对于反应①,温度越高平衡常数越大,说明升高温度平衡向正反应移动,据此判断a值的符号.
(2)由表中数据可知,对于反应①,温度越高平衡常数越大,说明升高温度平衡向正反应移动,据此判断a值的符号.
解答:
解:(1)令平衡时CO的浓度为cmol/L,则:
Fe(s)+CO2(g)═FeO(s)+CO(g)
开始(mol/L):2 0
变化(mol/L):c c
平衡(mol/L):2-c c
故
=1,解得c=1,
故答案为:1mol/L;
(2)由表中数据可知,对于反应①,温度越高平衡常数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应进行,故a>0,
故答案为:大于.
Fe(s)+CO2(g)═FeO(s)+CO(g)
开始(mol/L):2 0
变化(mol/L):c c
平衡(mol/L):2-c c
故
| c |
| 2-c |
故答案为:1mol/L;
(2)由表中数据可知,对于反应①,温度越高平衡常数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应进行,故a>0,
故答案为:大于.
点评:本题目涉及化学平衡计算、影响化学平衡移动的因素等知识,难度中等.

练习册系列答案
相关题目
如图,关闭活塞K,向A中充入1molX、1molY,向B中充入2molX、2molY,此时A的容积是a L,B的容积是2aL.在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L.下列说法错误的是( )


| A、反应速率:v(B)>v(A) |
| B、A 容器中X的转化率为80% |
| C、若打开K,则A的体积变为2.6a L |
| D、平衡时Y的体积分数:A<B |
下列各组物质,不能按 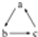 (“-→”表示反应一步完成)关系转化的是( )
(“-→”表示反应一步完成)关系转化的是( )
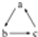 (“-→”表示反应一步完成)关系转化的是( )
(“-→”表示反应一步完成)关系转化的是( )| 选项 | a | b | c |
| A | Al2O3 | NaAlO2 | Al(OH)3 |
| B | AlCl3 | Al(OH)3 | NaAlO2 |
| C | Al | Al(OH)3 | Al2O3 |
| D | MgCl2 | Mg(OH)2 | MgO |
| A、A | B、B | C、C | D、D |
CH4分子是以碳原子为中心的正四面体结构,而不是正方形的平面结构,理由是( )
| A、CH3Cl不存在同分异构现象 |
| B、CH2Cl2不存在同分异构现象 |
| C、CHCl3不存在同分异构现象 |
| D、CH4是气体分子 |