题目内容
某温度下H2(g)+I2(g)?2HI(g)的平衡常数是50,在该温度下只充入H2与I2(g)发生反应,反应开始时,碘蒸气的浓度是1mol?L-1,当达到平衡时c(HI)=0.9mol?L-1,求H2的转化率?(保留三位有效数字)
考点:化学平衡的计算
专题:化学平衡专题
分析:依据化学平衡三段式列式计算,设c(H2)的起始浓度为xmol/L.c(H2)的平衡浓度为ymol/L.
H2+I2(g)?2HI
起始浓度(mol/L) x 1 0
转化浓度(mol/L) 0.45 0.45 0.9
平衡浓度(mol/L) y 0.55 0.9
结合平衡常数概念计算得到y,转化率=
×100%;
H2+I2(g)?2HI
起始浓度(mol/L) x 1 0
转化浓度(mol/L) 0.45 0.45 0.9
平衡浓度(mol/L) y 0.55 0.9
结合平衡常数概念计算得到y,转化率=
| 消耗量 |
| 起始量 |
解答:
解:设c(H2)的起始浓度为xmol/L.
c(H2)的平衡浓度为ymol/L.
H2+I2(g)?2HI
起始浓度(mol/L) x 1 0
转化浓度(mol/L) 0.45 0.45 0.9
平衡浓度(mol/L) y 0.55 0.9
则K=
=50
y=0.0295mol/L
x=0.0295+0.45=0.4795mol/L
H2转化率=
100%=93.8%
答:H2的转化率为93.8%;
c(H2)的平衡浓度为ymol/L.
H2+I2(g)?2HI
起始浓度(mol/L) x 1 0
转化浓度(mol/L) 0.45 0.45 0.9
平衡浓度(mol/L) y 0.55 0.9
则K=
| 0.92 |
| 0.55×y |
y=0.0295mol/L
x=0.0295+0.45=0.4795mol/L
H2转化率=
| 0.45mol/L |
| 0.4795mol/L |
答:H2的转化率为93.8%;
点评:本题考查了化学平衡计算,平衡常数概念计算的分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
合成氨工业中的H2是通过反应CO+H2O?CO2+H2制得的.现在一定温度下,将1molCO和3mol水蒸气置于密闭容器中反应,达平衡后测得CO2为0.75mol,再通入6mol水蒸气,重新达到平衡后,CO2和H2的物质的量之和为( )
| A、1.2 mol |
| B、1.5 mol |
| C、1.8 mol |
| D、2.5 mol |
将4mol A气体和2mol B气体在2L的恒容容器中混合并在一定条件下发生:2A(g)+B(g)?2C(g),经2s后测得C的浓度为0.6mol.L-1,下列几种说法中正确的是( )
| A、用物质B表示反应的平均速率为0.3 mol?L-1?s-1 |
| B、2 s时气体密度与起始时气体密度之比为3:2 |
| C、2 s时物质A的转化率为70% |
| D、2 s时物质B的浓度为0.7 mol?L-1 |

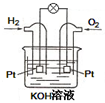 (1)已知:
(1)已知: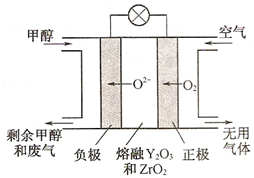
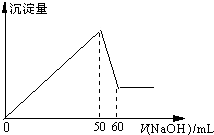 铝是应用最广泛的金属之一,铝的化合物在生产和生活中也有许多用途.
铝是应用最广泛的金属之一,铝的化合物在生产和生活中也有许多用途.