题目内容
氢溴酸在工业和医药领域中有着广泛的用途,如图是某兴趣小组模拟工厂制备氢溴酸粗品并精制的流程:

(1)混合①使用冰水的目的是 ;
(2)操作Ⅱ和Ⅲ的名称是 , ;
(3)混合②中发生反应的离子方程式为 ;
(4)用氢溴酸和大理石制得溴化钙中含有少量Al3+、Fe3+杂质,加入适量的试剂 (填化学式)后控制溶液的PH约为8.0即可除去杂质,控制溶液的PH约为8.0的目的是 .

(1)混合①使用冰水的目的是
(2)操作Ⅱ和Ⅲ的名称是
(3)混合②中发生反应的离子方程式为
(4)用氢溴酸和大理石制得溴化钙中含有少量Al3+、Fe3+杂质,加入适量的试剂
考点:氯、溴、碘及其化合物的综合应用,制备实验方案的设计
专题:卤族元素
分析:(1)Br2氧化SO2放出很多热量,溴易挥发.
(2)由工艺流程可知,操作Ⅱ分离固体与液体,应是过滤;操作Ⅲ为互溶的溶液组分的分离,应是蒸馏.
(3)混合②中发生反应是亚硫酸钠和溴单质发生氧化还原反应,生成硫酸钠和氢溴酸;
(4)铝在、铁离子水解显酸性,通过调节溶液PH可以使铝离子和铁离子完全沉淀除去,但不能引入新的杂质.
(2)由工艺流程可知,操作Ⅱ分离固体与液体,应是过滤;操作Ⅲ为互溶的溶液组分的分离,应是蒸馏.
(3)混合②中发生反应是亚硫酸钠和溴单质发生氧化还原反应,生成硫酸钠和氢溴酸;
(4)铝在、铁离子水解显酸性,通过调节溶液PH可以使铝离子和铁离子完全沉淀除去,但不能引入新的杂质.
解答:
解:(1)Br2氧化SO2放出很多热量,溴易挥发,使用冰水,降低体系温度,防止溴蒸发,使反应完全,
故答案为:降低体系温度,防止溴蒸发,使反应完全;
(2)由工艺流程可知,操作Ⅱ分离固体与液体,应是过滤;操作Ⅲ为互溶的溶液组分的分离,应是蒸馏.蒸馏一般适用与互溶的液体的分离,
故答案为:过滤;蒸馏;
(3)混合②中发生反应是亚硫酸钠和溴单质发生氧化还原反应,生成硫酸钠和氢溴酸,反应的离子方程式为:Br2+SO32-+H2O=2Br-+SO42-+2H+;
故答案为:Br2+SO32-+H2O=2Br-+SO42-+2H+;
(4)用氢溴酸和大理石制得溴化钙中含有少量Al3+、Fe3+杂质,加入适量的试剂,CaO或Ca(OH)2或CaCO3,和水解生成的酸反应促进铝离子、铁离子水解生成氢氧化铝沉淀,氢氧化铁沉淀,除去铁离子,铝离子,同时避免氢氧化铝溶解,且不引入新的杂质,
故答案为:CaO或Ca(OH)2或CaCO3,确保Fe3+和Al3+沉淀完全和防止氢氧化铝溶解.
故答案为:降低体系温度,防止溴蒸发,使反应完全;
(2)由工艺流程可知,操作Ⅱ分离固体与液体,应是过滤;操作Ⅲ为互溶的溶液组分的分离,应是蒸馏.蒸馏一般适用与互溶的液体的分离,
故答案为:过滤;蒸馏;
(3)混合②中发生反应是亚硫酸钠和溴单质发生氧化还原反应,生成硫酸钠和氢溴酸,反应的离子方程式为:Br2+SO32-+H2O=2Br-+SO42-+2H+;
故答案为:Br2+SO32-+H2O=2Br-+SO42-+2H+;
(4)用氢溴酸和大理石制得溴化钙中含有少量Al3+、Fe3+杂质,加入适量的试剂,CaO或Ca(OH)2或CaCO3,和水解生成的酸反应促进铝离子、铁离子水解生成氢氧化铝沉淀,氢氧化铁沉淀,除去铁离子,铝离子,同时避免氢氧化铝溶解,且不引入新的杂质,
故答案为:CaO或Ca(OH)2或CaCO3,确保Fe3+和Al3+沉淀完全和防止氢氧化铝溶解.
点评:本题以制备氢溴酸为载体,考查学生对工艺流程的理解、物质的分离提纯等基本操作、离子检验、物质性质等,难度中等,是对知识的综合运用,需学生具有扎实的基础知识与灵活运用知识解决问题的能力.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
纳米材料是指研究、开发出的直径从几纳米(nm)到几十纳米的材料(1nm=10-9m),如将纳米材料分散到液体分散剂中,所得混合物可能具有的性质是( )
| A、有丁达尔效应 |
| B、浑浊不透明 |
| C、不能透过滤纸 |
| D、所得分散系不稳定 |
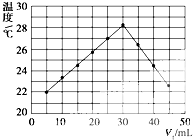 将V1 mL 1.00mol?L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1 mL 1.00mol?L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )| A、做该实验时环境温度为22℃ |
| B、该实验表明所有化学反应化学能只转化为热能 |
| C、NaOH溶液的浓度为1.50 mol?L-1 |
| D、该实验表明有水生成的反应都是放热反应 |
合成氨工业中的H2是通过反应CO+H2O?CO2+H2制得的.现在一定温度下,将1molCO和3mol水蒸气置于密闭容器中反应,达平衡后测得CO2为0.75mol,再通入6mol水蒸气,重新达到平衡后,CO2和H2的物质的量之和为( )
| A、1.2 mol |
| B、1.5 mol |
| C、1.8 mol |
| D、2.5 mol |
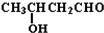
 +CO
+CO