题目内容
下列各组物质,不能按 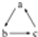 (“-→”表示反应一步完成)关系转化的是( )
(“-→”表示反应一步完成)关系转化的是( )
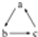 (“-→”表示反应一步完成)关系转化的是( )
(“-→”表示反应一步完成)关系转化的是( )| 选项 | a | b | c |
| A | Al2O3 | NaAlO2 | Al(OH)3 |
| B | AlCl3 | Al(OH)3 | NaAlO2 |
| C | Al | Al(OH)3 | Al2O3 |
| D | MgCl2 | Mg(OH)2 | MgO |
| A、A | B、B | C、C | D、D |
考点:镁、铝的重要化合物
专题:几种重要的金属及其化合物
分析:A、氧化铝溶于氢氧化钠生成偏铝酸钠,偏铝酸钠通入二氧化碳生成氢氧化铝,氢氧化铝加热分解生成氧化铝,据此解答即可;
B、氯化铝与氨水反应生成氢氧化铝,氢氧化铝加热分解生成氧化铝,氧化铝电解得到铝,据此解答即可;
C、铝不能直接生成氢氧化铝,据此解答即可;
D、氯化镁与氢氧化钠反应生成氢氧化镁,氢氧化镁加热分解生成氧化镁,氧化镁与稀盐酸反应生成氯化镁,据此解答即可.
B、氯化铝与氨水反应生成氢氧化铝,氢氧化铝加热分解生成氧化铝,氧化铝电解得到铝,据此解答即可;
C、铝不能直接生成氢氧化铝,据此解答即可;
D、氯化镁与氢氧化钠反应生成氢氧化镁,氢氧化镁加热分解生成氧化镁,氧化镁与稀盐酸反应生成氯化镁,据此解答即可.
解答:
解:A、氧化铝溶于氢氧化钠生成偏铝酸钠,偏铝酸钠通入二氧化碳生成氢氧化铝,氢氧化铝加热分解生成氧化铝,故A正确;
B、氯化铝与氨水反应生成氢氧化铝,氢氧化铝加热分解生成氧化铝,氧化铝电解得到铝,故B正确;
C、铝不能直接生成氢氧化铝,故C错误;
D、氯化镁与氢氧化钠反应生成氢氧化镁,氢氧化镁加热分解生成氧化镁,氧化镁与稀盐酸反应生成氯化镁,故D正确;
故选C.
B、氯化铝与氨水反应生成氢氧化铝,氢氧化铝加热分解生成氧化铝,氧化铝电解得到铝,故B正确;
C、铝不能直接生成氢氧化铝,故C错误;
D、氯化镁与氢氧化钠反应生成氢氧化镁,氢氧化镁加热分解生成氧化镁,氧化镁与稀盐酸反应生成氯化镁,故D正确;
故选C.
点评:本题考查元素化合物的性质,题目难度不大,本题注意常见元素化合物性质的积累.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
已知:
①NH3(g)+HCl(g)═NH4Cl(s)△H1=-176kJ/mol
②NH3(g)=NH3(aq)△H2=-35.1kJ/mol
③HCl(g)=HCl(aq)△H3=-72.3kJ/mol
④NH3(aq)+HCl(aq)═NH4Cl(aq)△H4=-52.3kJ/mol
则反应NH4Cl(s)=NH4Cl(aq)的△H5为( )
①NH3(g)+HCl(g)═NH4Cl(s)△H1=-176kJ/mol
②NH3(g)=NH3(aq)△H2=-35.1kJ/mol
③HCl(g)=HCl(aq)△H3=-72.3kJ/mol
④NH3(aq)+HCl(aq)═NH4Cl(aq)△H4=-52.3kJ/mol
则反应NH4Cl(s)=NH4Cl(aq)的△H5为( )
| A、+16.3 kJ/mol |
| B、-16.3 kJ/mol |
| C、+335.7 kJ/mol |
| D、-335.7 kJ/mol |
下列关于油脂的说法不正确的是( )
| A、油脂属于酯类 |
| B、油脂的密度比水小,不溶于水 |
| C、油脂可分为油和脂肪 |
| D、油脂属于高分子化合物 |
已知A是一种金属单质,B显淡黄色,其转化关系如图所示,则关于C的以下性质错误的是( )

| A、易溶于水 |
| B、与澄清石灰水反应产生白色沉淀 |
| C、与足量盐酸反应放出气体 |
| D、属于碱 |
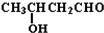
 +CO
+CO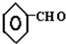
 (1)已知:
(1)已知: