题目内容
对实验Ⅰ~Ⅳ的实验现象预测正确的是( )
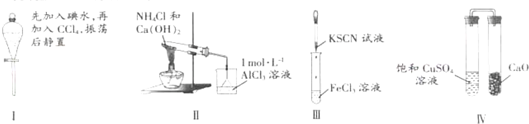

| A、实验Ⅰ:液体分层,下层呈无色 |
| B、实验Ⅱ:烧杯中先出现白色沉淀,后溶解 |
| C、实验Ⅲ:试管中溶液颜色仍无色 |
| D、实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.四氯化碳的密度大于水,碘在四氯化碳中的溶解度大于在水中的溶解度;
B.氢氧化铝不溶于弱碱,能溶于强碱;
C.溶液呈血红色;
D.根据CaO吸水并放热分析.
B.氢氧化铝不溶于弱碱,能溶于强碱;
C.溶液呈血红色;
D.根据CaO吸水并放热分析.
解答:
解:A.四氯化碳的密度大于水,碘在四氯化碳中的溶解度大于在水中的溶解度,所以液体分层,且下层呈紫色,故A错误;
B.氨气和氯化铝反应生成氢氧化铝,氢氧化铝不溶于氨水,所以能产生白色沉淀,故B错误;
C.氯化铁与KSCN反应生成Fe(SCN)3,溶液呈红色,故C错误;
D.CaO吸水生成氢氧化钙,饱和CuSO4溶液中水减少,会析出蓝色晶体,故D正确.
故选D.
B.氨气和氯化铝反应生成氢氧化铝,氢氧化铝不溶于氨水,所以能产生白色沉淀,故B错误;
C.氯化铁与KSCN反应生成Fe(SCN)3,溶液呈红色,故C错误;
D.CaO吸水生成氢氧化钙,饱和CuSO4溶液中水减少,会析出蓝色晶体,故D正确.
故选D.
点评:本题考查了化学实验评价,明确实验原理是解本题关键,涉及萃取、氢氧化铝制取、饱和溶液等知识点,根据这些物质的性质来分析解答,易错选项是D,很多同学往往漏掉氧化钙和水反应放出热量而导致错误判断,为易错点.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
侯氏制碱法制备的工业产物主要是( )
| A、碳酸钠 | B、氢氧化钠 |
| C、碳酸氢钠 | D、氯化铵 |
下列实验操作中不正确的是( )
| A、用规格为10mL的量筒量取6.2mL的液体 |
| B、用蒸发方法使NaCl从溶液中析出时,应边加热边搅拌直至溶液完全蒸干 |
| C、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| D、制取蒸馏水时,冷凝管中冷凝水应由下口进,上口出 |
用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:下列叙述正确的是( )


| A、试剂X可以是盐酸 |
| B、反应①过滤后所得沉淀为氢氧化铁 |
| C、图中所示转化反应都不是氧化还原反应 |
| D、操作②中发生的化学方程式为NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO3 |
下列各组离子在给定条件下,能大量共存的是( )
| A、含有NO3-的水溶液中:NH4+、Fe2+、SO42-、H+ |
| B、含有CO32-的澄清透明溶液中:K+、NO3-、Cl-、Na+ |
| C、在pH=2的溶液中:ClO-、SO32-、Na+、K+ |
| D、能与铝粉反应生成氢气的溶液中:Na+、Al3+、CH3COO-、I- |