题目内容
 某同学研究铝及其化合物的性质时设计了如下两个实验方案.
某同学研究铝及其化合物的性质时设计了如下两个实验方案.方案一:2.7g Al
| 100mL稀盐酸 |
| NaOH溶液 |
方案二:2.7g Al
| 100mLNaOH溶液 |
| 稀盐酸 |
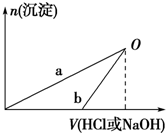
已知:NaOH溶液和稀盐酸的浓度均是3mol?L-1,如图是向X溶液和Y溶液中分别加入NaOH溶液和稀盐酸时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法正确的是( )
| A、在O点时两方案中所得溶液的溶质物质的量相等 |
| B、b曲线表示的是向X溶液中加入NaOH溶液 |
| C、X溶液溶质为AlCl3,Y溶液溶质为NaAlO2 |
| D、a、b曲线表示的反应都是氧化还原反应 |
考点:性质实验方案的设计,镁、铝的重要化合物
专题:
分析:由实验方案可知,方案一:2.7g Al
X溶液
Al(OH)3沉淀;
方案二:2.7g Al
Y溶液
Al(OH)3沉淀,n(Al)=
=0.1mol,n(HCl)=3 mol/L×0.1 L=0.3 mol,n(NaOH)=3 mol/L×0.1 L=0.3mol,由2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,酸完全反应,而NaOH剩余,则图中b表示向Y中加盐酸,a表示向X中加NaOH,以此来解答.
| 100mL稀盐酸 |
| NaOH溶液 |
方案二:2.7g Al
| 100mLNaOH溶液 |
| 稀盐酸 |
| 2.7g |
| 27g/mol |
解答:
解:A.在O点时,沉淀达到最大,所得溶液中只有氯化钠溶质,与向X溶液和Y溶液中分别加入NaOH和HCl的浓度及体积相等,根据原子守恒,所以O点时两方案中所得溶液浓度相等,故A正确;
B.b中开始不生成沉淀,则b表示向Y中加盐酸,故B错误;
C.根据以上分析知,X溶液中溶质是AlCl3,Y溶液溶质为NaAlO2、NaOH,故C错误;
D.a表示的是氯化铝和氢氧化钠的复分解反应,b表示的是偏铝酸钠、NaOH分别和盐酸的反应,均为复分解反应,故D错误.
故选A.
B.b中开始不生成沉淀,则b表示向Y中加盐酸,故B错误;
C.根据以上分析知,X溶液中溶质是AlCl3,Y溶液溶质为NaAlO2、NaOH,故C错误;
D.a表示的是氯化铝和氢氧化钠的复分解反应,b表示的是偏铝酸钠、NaOH分别和盐酸的反应,均为复分解反应,故D错误.
故选A.
点评:本题考查性质实验方案的设计,为高频考点,把握发生的反应及量的关系、图象分析为解答的关键,侧重分析、计算、实验能力的综合考查,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某温度下,H2(g)+CO2(g)?H2O(g)+CO(g)的平衡常数K=2.25.该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示.下列判断不正确的是( )
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol?L-1 | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol?L-1 | 0.010 | 0.010 | 0.020 |
| A、平衡时,乙中CO2、H2的转化率相等 |
| B、平衡时,甲中和丙中H2转化率均是60% |
| C、平衡时,丙中c(CO2)是甲中的2倍,是0.008mol?L-1 |
| D、反应开始时,丙中的反应速率最快,甲中的反应速率最慢 |
 .
.

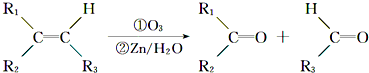
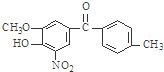 ,该有机物中含氧官能团有:
,该有机物中含氧官能团有: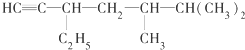 的系统名称是
的系统名称是
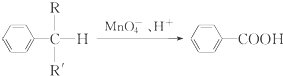 (R、R′表示烷基或氢原子)
(R、R′表示烷基或氢原子)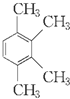 、
、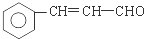 在强氧化剂条件下生成
在强氧化剂条件下生成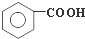 和另一种有机物
和另一种有机物