��Ŀ����
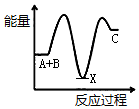
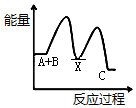
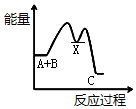
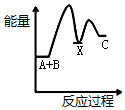
12��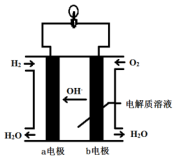 Ӣ��һ�ҹ�˾�����з�ȫ�����һ�ε磬�����족�ļ�������ȼ���ֻ���أ���ͼΪ��������ȼ�ϵ�ؽṹʾ��ͼ��
Ӣ��һ�ҹ�˾�����з�ȫ�����һ�ε磬�����족�ļ�������ȼ���ֻ���أ���ͼΪ��������ȼ�ϵ�ؽṹʾ��ͼ����ش��������⣮
��1������ǽ���ѧ��ֱ��ת��Ϊ�����ܵ�װ�ã�
��2������ȼ�ϵ���з�����Ӧ�Ļ�ѧ����ʽ��2H2+O2�T2H2O����Ϊ��������ȼ�ϵ�أ��õ�صĵ������Һ������KOH��Һ��
��3��b �缫�ϵķ�ӦΪ����õ缫Ϊ��ص���������������ԭ�Ƕȷ������÷�Ӧ���ڻ�ԭ��Ӧ��Ӧ��
��4������ȼ�ϵ������ͨ�����ȣ����ŵ�������Ⱦ������ѭ�������ã����һ�㼴�ɣ�������Ϊ�ֻ���أ���ʱ��ʹ��ʱ����о��ֻ����̣�������Ϊ��һ��������ת��Ϊ���ܣ�����������Ҫ���һЩ���⣬�磺�ֻ��DZ���һ�������ף����ܵ�ԭ����������ˮ������ɢ����
���� ��������ȼ�ϵ���ǽ���ѧ��ת���ɵ��ܵ�װ�ã��������Һ��KOH��Һ����ع���ʱ���ڸ�����������������ʧ���ӷ���������Ӧ���缫��ӦΪH2+2OH--2e-�T2H2O�����������������������õ��ӷ�����ԭ��Ӧ���缫��ӦΪ2H2O+O2+4e-=4OH-������ܷ�ӦΪ2H2+O2=2H2O���õ�صIJ�����ˮ��������������������������ת���ʽϸߣ�����80%���ݴ˽��
��� �⣺��1��ȼ�ϵ���ǽ���ѧ��ת���ɵ��ܵ�װ�ã��ʴ�Ϊ�����ܣ�
��2����������ȼ�ϵ���еĵ������Һһ����KOH��Һ������ܷ�Ӧ��������������Ӧ����ˮ����Ӧ����ʽΪ2H2+O2=2H2O��
�ʴ�Ϊ��2H2+O2=2H2O��KOH��Һ��
��3������������������b �缫�������õ��ӷ�����ԭ��Ӧ���缫��Ӧ����ʽ��2H2O+O2+4e-=4OH-��
�ʴ�Ϊ��������ԭ��Ӧ��
��4������ȼ�ϵ�صIJ�����ˮ������ͨ�����ȣ�����Ⱦ������ѭ�������ã��ֻ���س�ʱ��ʹ��ʱ��о��ֻ����̣�����Ϊ��һ��������ת��Ϊ���ܣ�����ֻ��DZ���һ�������ף����ܵ�ԭ����������ˮ������ɢ����
�ʴ�Ϊ������Ⱦ������ѭ�������ã��ȣ�������ˮ������ɢ����
���� ���⿼����ȼ�ϵ�صĹ���ԭ����ȼ�ϵ���и�����ȼ�Ϸ���������Ӧ������������������ԭ��Ӧ��ע�⻯ѧ��ʵ���������ϵ����Ŀ�ѶȲ���

 ���㼤�������100�ִ��Ծ�ϵ�д�
���㼤�������100�ִ��Ծ�ϵ�д�| ������ | Fe��OH��3 | Cu��OH��2 | Al��OH��3 |
| ��ʼ������pH | 1.9 | 4.7 | 3.4 |
| ������ȫ��pH | 3.2 | 6.7 | 4.7 |
| A�� | ���¶���Ksp[Fe��OH��3]=1��10-14.6 | |
| B�� | W��Ҫ���� Cu��OH��2��Al��OH��3 | |
| C�� | ��ҺX��һ������Cu2+��Fe3+��SO42- | |
| D�� | ȡ��ҺY������ɫ��Ӧ�����ж���ҺX���Ƿ���Na+ |
| A | B | ||
| D | E | G | J |
| L | M | Q |
��2��G2J2�������ĵ�����������������ʽΪ
 ��д��һ���ܱ�ʾԪ��G��J�ǽ�����ǿ����ϵ�Ļ�ѧ����ʽH2S+Cl2=2HCl+S����Na2S+Cl2=2NaCl+S����
��д��һ���ܱ�ʾԪ��G��J�ǽ�����ǿ����ϵ�Ļ�ѧ����ʽH2S+Cl2=2HCl+S����Na2S+Cl2=2NaCl+S������3��G�����ڿ�����ȼ������һ����ɫ�д̼�����ζ�����壬����ɫ�д̼�����ζ�������뺬1molJ��һ�ֺ����ᣨ�����ij�γ�����ʵ������ȡ����������Һ��-�������·�Ӧ��������һ��ǿ���һ��������Ҹ÷�Ӧ����NA������ת�ƣ���÷�Ӧ�Ļ�ѧ����ʽ��SO2+2HClO3$\frac{\underline{\;һ������\;}}{\;}$H2SO4+2ClO2��
��4��A������⻯���Ǽ��ԣ�����ԡ��Ǽ��ԡ������ӣ�ʵ�����Ʊ������ʵĻ�ѧ����ʽΪ2NH4Cl+Ca��OH��2$\frac{\underline{\;\;��\;\;}}{\;}$2NH3��+CaCl2+2H2O��NH3•H2O$\frac{\underline{\;\;��\;\;}}{\;}$NH3��+H2O��
��5������Ԫ�������ɣ������Ʋ��ϱ��г�����Ԫ�صĵ��ʾ��а뵼�����Ե���Ge��As����Ԫ�ط��ţ���
| A�� | pH=2��HA��Һ��pH=12��MOH��Һ����Ȼ�ϣ�c��H+��+c��M+���Tc��OH-��+c��A-�� | |
| B�� | 1 L 0.1 mol•L-1 ��NH4��2Fe��SO4��2����Һ�У�c��SO${\;}_{4}^{2-}$����c��NH${\;}_{4}^{+}$����c��Fe2+����c��H+����c��OH-�� | |
| C�� | 0.1 mol•L-1 NaHCO3��Һ�У�c��H+��+c��H2CO3���Tc��CO${\;}_{3}^{2-}$��+c��OH-�� | |
| D�� | 0.1mol•L-1��NaHA��Һ����pH=4��c��HA-����c��H+����c��H2A����c��A2-�� |
| A�� | �ȶ��ԣ�NH3��PH3��SiH4 | B�� | ���ԣ�HClO4��H2SO4��H3PO4 | ||
| C�� | ���ԣ�KOH��NaOH��Mg��OH��2 | D�� | �����ԣ�F2��Cl2��Br2 |
 ij��ѧ������ȤС��Ϊ̽��ͭ��Ũ���ᷴӦ�����������ʣ�������ͼ��ʾ��װ�õ���Ͻ���ʵ�飮
ij��ѧ������ȤС��Ϊ̽��ͭ��Ũ���ᷴӦ�����������ʣ�������ͼ��ʾ��װ�õ���Ͻ���ʵ�飮