题目内容
16.某学生做乙醛的还原性实验时,取1mol/L CuSO4溶液和0.5mol/L NaOH溶液各1mL,在一支洁净的试管内混合后,向其中又加入0.5mL40%的乙醛,加热,结果无红色沉淀出现.导致该实验失败的原因可能是( )| A. | 加入NaOH溶液的量不够 | B. | 加入乙醛太少 | ||
| C. | 加入CuSO4溶液的量不够 | D. | 加入乙醛的量太多 |
分析 乙醛和新制的Cu(OH)2反应,该反应的本质是:乙醛中的醛基具有还原性,新制的氢氧化铜具有氧化性,醛基与氢氧化铜中的+2价的铜发生氧化还原反应,操作的关键是碱要过量,据此,即可解答.
解答 解:A.n(CuSO4)=1mol/L×0.001L═0.001mol,根据反应:
CuSO4+2NaOH═Cu(OH)2↓+2Na2SO4
可知:n(NaOH)=2n(CuSO4)=0.002mol,n(NaOH)=0.5mol/L×V
V=4mL,应该加0.5mol/L NaOH溶液4mL,实际只加了1mL,NaOH溶液的量不够,故A正确;
B.该反应的本质是:乙醛中的醛基具有还原性,新制的氢氧化铜具有氧化性,醛基与氢氧化铜中的+2价的铜发生氧化还原反应,只要有醛基即可反应,故B错误;
C.n(NaOH)=0.5mol/L×0.001L═0.0005mol,根据反应:CuSO4+2NaOH═Cu(OH)2↓+2Na2SO4
可知:n(NaOH)=2n(CuSO4),n(CuSO4)=0.00025mol,应该加CuSO4 0.25mL,实际加了1mL,故C错误;
D.乙醛和新制的Cu(OH)2反应:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O,条件是碱性,加入乙醛多少和反应现象无直接关系,只要有醛基加热反应会出现红色沉淀,故D错误;
故选A.
点评 本题考查有机物乙醛和新制的Cu(OH)2反应,碱要过量的条件是解答的关键,难度中等.

练习册系列答案
相关题目
6.下列说法正确的是( )
| A. | 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 | |
| B. | 根据Ksp(CaCO3)<Ksp(CaSO4),在生产中可用Na2CO3溶液处理锅炉水垢中的CaSO4,使之转化为疏松、易溶于酸的CaCO3 | |
| C. | 常温下,将醋酸稀溶液加水稀释,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$减小 | |
| D. | 已知反应:3H2(g)+WO3(s)=W(s)+3H2O(g)只有在高温时才能自发进行,则它的△S<0 |
7.下列各组中两个化学反应,属于同一反应类型的一组是( )
| A. | 由苯制硝基苯;由苯制环己烷 | |
| B. | 由乙烯制1,2-二溴乙烷;由乙烷制一氯乙烷 | |
| C. | 由苯制溴苯;CH4制CH2Cl2 | |
| D. | 乙烯使溴水褪色;乙烯使酸性高锰酸钾溶液褪色 |
4.石油是一种重要能源,人类正面临着石油短缺、油价上涨的困惑.以下解决能源问题的方法不当的是( )
| A. | 用木材作燃料 | B. | 用乙醇替代汽油 | C. | 开发风能 | D. | 开发地热 |
11.下列各组混合物中,不能用分液漏斗分离的是( )
| A. | 正戊烷和水 | B. | 溴乙烷和水 | C. | 乙酸和乙醇 | D. | 苯和水 |
6.下列用电子式表示化合物的形成过程,正确的是( )
| A. |  | |
| B. |  | |
| C. |  | |
| D. |  |
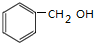
 ,该反应用于苯酚的定性检验和定量测定.
,该反应用于苯酚的定性检验和定量测定.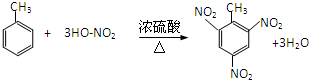 .
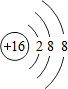
.
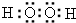 .
.