题目内容
20. 现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其它五种元素都是短周期元素.X、Y、E三种元素组成的化合物是实验室常用燃料.取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体.请回答下列问题:
现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其它五种元素都是短周期元素.X、Y、E三种元素组成的化合物是实验室常用燃料.取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体.请回答下列问题:(1)写出基态G原子电子排布式:1s22s22p63s23p63d104s1或[Ar]3d104s1;Y、Z、E、F、G的第一电离能最大的是N(用元素符号表示).
(2)X、Y、Z形成3原子分子M,每个原子价层电子均达到稳定结构.M分子的结构式为H-C≡N.1molM含π键数目为2×6.02×1023或2NA.
(3)根据价层电子对互斥理论(VESPR)推测:ZE2-的立体构型为V形或角形,YE32-的中心原子杂化类型为sp2.
(4)Z与X形成的简单化合物极易溶解在E与X形成的简单化合物的原因是H2O、NH3之间易形成氢键.
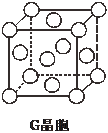
(5)G晶胞结构如图所示.已知立方体的棱长为apm,G 晶体密度为bg•cm-3,则阿伏加德罗常数NA=$\frac{256×1{0}^{30}}{{a}^{3}b}$mol-1(用含a、b的代数式表示).
分析 X、Y、E三种元素组成的化合物是实验室常用燃料,也是一种家庭常见饮品的主要成分,可知该燃料为酒精,所以X为氢元素、Y为碳元素、E为氧元素,X、Y、Z、E的原子序数依次增大,所以Z为氮元素,F的化合物做焰色反应实验,其焰色呈黄色,F为钠元素,G的单质是生活中常见的一种金属,E是氧元素,GE是黑色固体.G2E是红色固体,所以G是铜元素,据此答题.
解答 解:X、Y、E三种元素组成的化合物是实验室常用燃料,也是一种家庭常见饮品的主要成分,可知该燃料为酒精,所以X为氢元素、Y为碳元素、E为氧元素,X、Y、Z、E的原子序数依次增大,所以Z为氮元素,F的化合物做焰色反应实验,其焰色呈黄色,F为钠元素,G的单质是生活中常见的一种金属,E是氧元素,GE是黑色固体.G2E是红色固体,所以G是铜元素,
(1)G是铜元素,原子序数是29,所以基态铜原子电子排布式为1s22s22p63s23p63d104s1 或[Ar]3d104s1,在同一周期中从左向右,第一电离能逐渐增大,但第ⅡA族和第ⅤA族元素由于最外层处于全满和半满状态,所以第一电离能都高于相邻主族的元素,同一主族从上到下,第一电离能逐渐减小,所以C、N、O、Na、Cu的第一电离能由小到大的顺序为 Na<Cu<C<O<N,
故答案为:1s22s22p63s23p63d104s1 或[Ar]3d104s1;N;
(2)X、Y、Z形成3原子分子M,每个原子价层电子均达到稳定结构,所以M的分子式为HCN,其结构式为H-C≡N,根据结构式可知,1mol HCN中含π键数目为2×6.02×1023或2NA,
故答案为:H-C≡N;2×6.02×1023或2NA;
(3)ZE2-为NO2-,YE32-为CO32-,NO2-中氮原子的价层电子对数为$\frac{5+1}{2}$=3,氮原子有一对孤电子对,所以NO2-的空间构型为V形或角形,CO32-中碳原子的价层电子对数为$\frac{4+2}{2}$=3,所以碳原子的杂化方式为sp2杂化,
故答案为:V形或角形; sp2;
(4)E、Z分别与X形成的简单化合物为H2O、NH3,由于水分子与氨分子之间者存在氢键,所以极易溶解,
故答案为:H2O、NH3之间易形成氢键;
(5)根据晶胞结构图可知,每个铜晶胞中含有铜原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,根据b=$\frac{\frac{4×64}{{N}_{A}}}{(a×1{0}^{-10})^{3}}$,可得NA=$\frac{256×1{0}^{30}}{{a}^{3}b}$mol-1,
故答案为:$\frac{256×1{0}^{30}}{{a}^{3}b}$mol-1.
点评 本题主要考查了核外电子排布、分子结构、微粒结构、晶胞计算等知识点,中等难度,解题关键在根据元素周期表及原子结构推断元素种类.

 名校课堂系列答案
名校课堂系列答案| 序号 | 浓硝酸与水的体积比 | 实 验 现 象 |
| Ⅰ | 1﹕1 | 反应速率快,溶液很快变成蓝色,铜丝表面有大量气泡冒出,气体呈红棕色 |
| Ⅱ | 1﹕3 | 反应速率较快,溶液变成蓝色,铜丝表面有大量气泡冒出,气体无色 |
| Ⅲ | 1﹕5 | 反应速率慢,微热后速率加快,溶液变成蓝色,铜丝表面有气泡冒出,气体无色 |
(2)兴趣小组以木炭和浓硝酸为起始原料,探究一氧化氮与过氧化钠反应制备亚硝酸钠.设计装置如下(忽略装置中空气的影响),请回答下列问题:
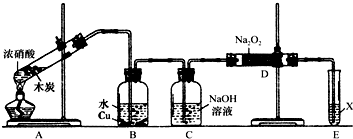
①组装好仪器后,必须进行的一项操作是:检查装置的气密性.
②推测B中可以观察到的主要现象是:铜片逐渐溶解,溶液逐渐变蓝,产生无色气泡;C装置的作用是:除去NO中混有的CO2.
③装置D中除生成NaNO2外,还有另一种固态物质Y,Y的化学式是:NaOH.可以通过适当改进,不产生Y物质,请你提出改进方法:用装有碱石灰的干燥管代替C装置.
④E装置的实验目的是:尾气处理,防止有害气体对大气污染.
 )的一氯代物有( )
)的一氯代物有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | H2O | B. | HCl | C. | NH4Cl | D. | CO2 |
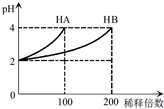 常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )
常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )| A. | HA的电离方程式为HA?H++A- | |
| B. | 稀释前,c(HB)>c(HA)=0.01 mol•L-1 | |
| C. | 0.1mol/L NaB溶液中:c(H+)=c(OH-)+C(HB) | |
| D. | NaA、NaB的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB) |
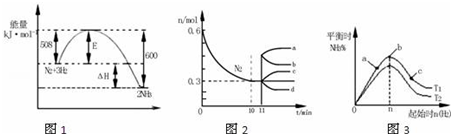
| A. | 由图1可知2NH3(g)?N2(g)+3H2(g)△H=-92kJ•mol-1 | |
| B. | 图2中0~10min内该反应的平均速率v(H2)=0.045mol•L-1•min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d | |
| C. | 图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点 | |
| D. | 图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2 |
| A. | H2 | B. | NH3 | C. | H2O | D. | CH4 |
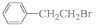 与过量NaOH醇溶液共热时发生了消去反应的是( )
与过量NaOH醇溶液共热时发生了消去反应的是( )| A. | 混合体系$\stackrel{溴水}{→}$Br2的颜色褪去 | |
| B. | 混合体系$\stackrel{足量稀HNO_{3}}{→}$ $\stackrel{AgNO_{3}溶液}{→}$淡黄色沉淀 | |
| C. | 混合体系$\stackrel{提取}{→}$有机物$\stackrel{酸性KMnO_{4}溶液}{→}$紫色褪去 | |
| D. | 混合体系$\stackrel{提取}{→}$有机物$\stackrel{Br_{2}的CCl_{4}溶液}{→}$Br2的颜色褪去 |

| A. | 甲、乙两烧杯中水电离出OH-浓度:甲<乙 | |
| B. | 分别稀释相同倍数,溶液pH变化:甲=乙 | |
| C. | 相同条件,AgCl(s)在甲中溶解度大于在乙中 | |
| D. | 向乙烧杯加入l0.0mL 0.1mol/L NaOH溶液后一定存在:c(H+)=c(CH3COO-)+c(OH-) |