题目内容
10.(1)HNO3与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:用浓硝酸和水按照不同体积比配成不同浓度的硝酸溶液,各取10mL硝酸溶液分别与铜片反应,实验记录如下:| 序号 | 浓硝酸与水的体积比 | 实 验 现 象 |
| Ⅰ | 1﹕1 | 反应速率快,溶液很快变成蓝色,铜丝表面有大量气泡冒出,气体呈红棕色 |
| Ⅱ | 1﹕3 | 反应速率较快,溶液变成蓝色,铜丝表面有大量气泡冒出,气体无色 |
| Ⅲ | 1﹕5 | 反应速率慢,微热后速率加快,溶液变成蓝色,铜丝表面有气泡冒出,气体无色 |
(2)兴趣小组以木炭和浓硝酸为起始原料,探究一氧化氮与过氧化钠反应制备亚硝酸钠.设计装置如下(忽略装置中空气的影响),请回答下列问题:
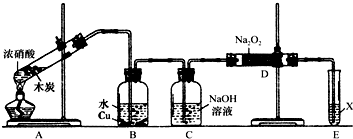
①组装好仪器后,必须进行的一项操作是:检查装置的气密性.
②推测B中可以观察到的主要现象是:铜片逐渐溶解,溶液逐渐变蓝,产生无色气泡;C装置的作用是:除去NO中混有的CO2.
③装置D中除生成NaNO2外,还有另一种固态物质Y,Y的化学式是:NaOH.可以通过适当改进,不产生Y物质,请你提出改进方法:用装有碱石灰的干燥管代替C装置.
④E装置的实验目的是:尾气处理,防止有害气体对大气污染.
分析 (1)实验I气体呈红棕色为二氧化氮,实验Ⅱ、Ⅲ产生无色气体为NO,制备NO气体最适宜的方案应该是反应速率较快,制得的气体是一氧化氮的方案;
(2)以木炭和浓硝酸为起始原料,探究一氧化氮与过氧化钠反应制备亚硝酸钠,由图可知,组装好仪器后,先检查装置的气密性,A中发生C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,B中二氧化氮与水反应生成硝酸,然后Cu与硝酸反应生成一氧化氮,C中利用NaOH溶液吸收二氧化碳,在D中一氧化氮与过氧化钠反应生成亚硝酸钠,可能还发生水与过氧化钠的反应生成NaOH,X可用强氧化剂,如最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气,一氧化氮可被酸性KMnO4溶液氧化硝酸;结合信息可知在酸性溶液中,NO2-可将MnO4-还原为Mn2+,据氧化还原反应可知NO2-氧化生成NO3-,以此来解答.
①组装好仪器后,必须进行的一项操作是检查装置的气密性;
②B中二氧化氮与水反应生成硝酸,据此分析现象,C中利用NaOH溶液吸收二氧化碳;
③在D中一氧化氮与过氧化钠反应生成亚硝酸钠,可能还发生水与过氧化钠的反应生成NaOH,不产生NaOH,用装有碱石灰的干燥管代替C装置;
④X可用强氧化剂,如NO可被酸性KMnO4溶液氧化为硝酸,通过酸性高锰酸钾溶液除去剩余NO,生成硝酸,防止污染空气.
解答 解:(1)实验I气体呈红棕色为二氧化氮,实验Ⅱ、Ⅲ金属铜和硝酸反应生成硝酸铜和一氧化氮、水,方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,依据上表,实验Ⅱ的产物是NO,且反应速率较快(不用加热),所以制备NO气体最适宜的是实验Ⅱ,
故答案为:实验Ⅱ;产物是NO,反应速率较快(不用加热);
(2)①组装好仪器后,为确保装置气密性良好,实验必须进行的一项操作是检查装置的气密性,
故答案为:检查装置的气密性;
②根据装置图可知,A中产生的NO2在B中与水反应生成HNO3和NO,其中HNO3与铜反应,故铜片溶解,溶液变蓝,产生气泡;由于A中还产生了CO2,故在通入D之前应先用氢氧化钠溶液将其除去NO中混有的CO2;
故答案为:铜片逐渐溶解,溶液逐渐变蓝,产生无色气泡;除去NO中混有的CO2;
③由于NO通过氢氧化钠溶液进入D装置时会带入水蒸气,根据原子守恒可知,生成的固体物质应该还有NaOH;若要避免生成NaOH,应该除去水蒸气,则改进方法为用装有碱石灰的干燥管代替C装置,
故答案为:NaOH;用装有碱石灰的干燥管代替C装置;
④X可用强氧化剂,如NO可被酸性KMnO4溶液氧化为硝酸,通过酸性高锰酸钾溶液除去剩余一氧化氮,生成硝酸,防止污染空气,
故答案为:尾气处理,防止有害气体对大气污染.
点评 本题考查性质实验方案及实验装置的评价、探究一氧化氮与过氧化钠反应制备亚硝酸钠,把握装置的作用、气体的制备实验等为解答的关键,侧重分析与实验能力的考查,注意氮族元素化合物知识的综合应用,题目难度中等.

 考前必练系列答案
考前必练系列答案| A. | 电池工作室,锂电极反应式为Li-e-═Li+ | |
| B. | 若将石墨换成铁时,电池还能继续工作 | |
| C. | 电池工作时,电解质中的ClO4-运动到电池的石墨极 | |
| D. | 正极发生了还原反应 |
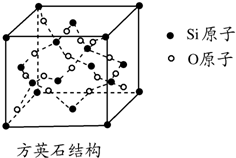 二氧化硅有晶体和无定形两种形态,晶态二氧化硅主要存在于石英矿中.除石英外,SiO2还有磷石英和方英石等多种变体.方英石结构和金刚石相似,其结构单元如图.下列有关说法正确的是( )
二氧化硅有晶体和无定形两种形态,晶态二氧化硅主要存在于石英矿中.除石英外,SiO2还有磷石英和方英石等多种变体.方英石结构和金刚石相似,其结构单元如图.下列有关说法正确的是( )| A. | 方英石晶体中存在着SiO4结构单元 | |
| B. | 1 mol Si形成2 mol Si-O键 | |
| C. | 上图所示的结构单元中实际占有18个硅原子 | |
| D. | 方英石晶体中,Si-O键之间的夹角为90° |
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(A) | n(B) | n(C) | ||
| ① | 700 | 4.0 | 1.0 | 1.80 |
| ② | 800 | 1.0 | 4.0 | 1.60 |
| ③ | 800 | 2.0 | 2.0 | a |
| ④ | 900 | 1.0 | 1.0 | b |
| A. | 实验①中,若10min达到平衡,则v(D)=9.0×10-2mol/(L•min) | |
| B. | 实验②中,该反应的平衡常数K=3.2 | |
| C. | 实验③中,达到平衡时A的转化率为60% | |
| D. | 实验④中,达到平衡时,b<1.0 |
| A. | 16 | B. | 17 | C. | 18 | D. | 19 |
 Mn、Fe均为第四周期过渡元素,部分电离能数据如表所示,请回答下列问题:
Mn、Fe均为第四周期过渡元素,部分电离能数据如表所示,请回答下列问题:| 元素 | Mn | Fe | |
| 电离能(kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(2)氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.则氯化铁的晶体类型为分子晶体.
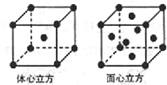
(3)金属铁的晶体在不同的温度下有两种堆积方式,如图所示.则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为1:2.
(4)下列分子或离子中,能提供孤电对与Cu2+形成配位键的是D.(填字母,下同)
①H2O ②NH3 ③F- ④CN-
A.仅①②B.仅①②③C.仅①②④D.①②③④
(5)向盛有硫酸铜溶液的试管中加入氨水,首先形成难溶物,继续加入氨水,难溶物溶解并得到深蓝色的透明溶液.下列叙述正确的是B.
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后生成深蓝色的[Cu(NH3)4]2+
C.若硫酸铜溶液中混有少量硫酸,则可用氨水除去硫酸铜溶液中的硫酸
D.[Cu(NH3)4]2+的空间构型为平面正方形.
 Ⅰ.某同学为探究元素周期表中同周期元素性质的递变规律,设计了如下系列实验.
Ⅰ.某同学为探究元素周期表中同周期元素性质的递变规律,设计了如下系列实验.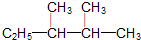 )的系统命名法的名称是2,3-二甲基戊烷;
)的系统命名法的名称是2,3-二甲基戊烷;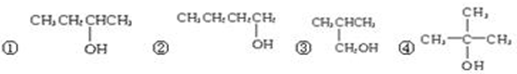
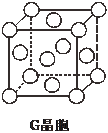 现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其它五种元素都是短周期元素.X、Y、E三种元素组成的化合物是实验室常用燃料.取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体.请回答下列问题:
现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其它五种元素都是短周期元素.X、Y、E三种元素组成的化合物是实验室常用燃料.取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体.请回答下列问题: