题目内容
7.元素①~⑩在周期表中的位置如表所示,试回答下列问题.周期 族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)元素 ②的气态氢化物的分子式是NH3;上述10种元素中,其最高价氧化物对应水化物的酸性最强的物质是HClO4(填化学式).
(3)用电子式表示元素③与④形成1:2型化合物的形成过程
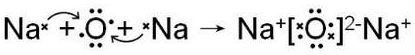 .
.(4)①②⑤元素的原子半径由小到大的顺序为N、C、Mg(用元素符号表示);③⑦⑩元素的气态氢化物的稳定性由强到弱的顺序为H2O、HCl、HBr(用氢化物的化学式表示).
(5)④和⑥两元素的最高价氧化物对应的水化物相互反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O.
分析 元素①~⑩在周期表中的位置如表所示,①为C,②为N,③为O,④为Na,⑤为Mg,⑥为Al,⑦为Cl,⑧为Ar,⑨为K,⑩为Br,
(1)0族元素化学性质稳定,金属性强的与水反应剧烈,同周期金属性减弱,同主族金属性增强;
(2)元素 ②的气态氢化物为氨气,非金属性最强的非金属形成最高价氧化物对应水化物的酸性最强,同周期非金属性增强,同主族非金属性减弱;
(3)元素③与④形成1:2型化合物为氧化钠,形成的是离子化合物;
(4)原子半径比较是电子层数越多半径越大,电子层数相同,核电荷数越大半径越小,③⑦⑩元素的气态氢化物的稳定性取决于非金属性强弱;
(5)④两元素的最高价氧化物对应的水化物为NaOH,⑥形成的最高价氧化物对应的水化物为氢氧化铝,是两性氢氧化物,溶于氢氧化钠溶液.
解答 解:元素①~⑩在周期表中的位置如表所示,①为C,②为N,③为O,④为Na,⑤为Mg,⑥为Al,⑦为Cl,⑧为Ar,⑨为K,⑩为Br,
(1)0族元素化学性质稳定,上述10种元素中,化学性质最不活泼的是Ar,金属性强的与水反应剧烈,同周期金属性减弱,同主族金属性增强,则与水反应最激烈的金属元素是K,
故答案为:Ar; K;
(2)元素 ②的气态氢化物为氨气,分子式是NH3,非金属性最强的非金属形成最高价氧化物对应水化物的酸性最强,同周期非金属性增强,同主族非金属性减弱,10种以上中其最高价氧化物对应水化物的酸性最强的物质是HClO4,
故答案为:NH3;HClO4;
(3)元素③与④形成1:2型化合物为氧化钠,形成的是离子化合物,电子式形成过程为: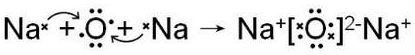 ,
,
故答案为: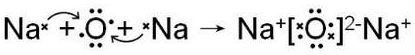 ;
;
(4)原子半径比较是电子层数越多半径越大,电子层数相同,核电荷数越大半径越小,①②⑤元素的原子半径由小到大的顺序为:N、C、Mg,③⑦⑩元素的气态氢化物的稳定性取决于非金属性强弱,③⑦⑩元素的气态氢化物的稳定性由强到弱的顺序为:H2O、HCl、HBr,
故答案为:N、C、Mg;H2O、HCl、HBr;
(5)④两元素的最高价氧化物对应的水化物为NaOH,⑥形成的最高价氧化物对应的水化物为氢氧化铝,是两性氢氧化物,溶于氢氧化钠溶液生成偏铝酸钠和水,反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O.
点评 本题考查了周期表结构、元素性质比较、周期表中同周期同主族递变规律、掌握基础是解题关键题目难度中等.

| A. | 二者分别与少量邻羟基苯甲酸作用,所得产物相同 | |
| B. | 若将二者均配成0.1mol/L的溶液,前者的pH较大 | |
| C. | 分别加入过量盐酸充分反应后,二者产生CO2的体积在标准状况下均为2.24L | |
| D. | 若将二者分别加入1mL水中充分搅拌,恢复至室温后,只有后者有固体剩余 |
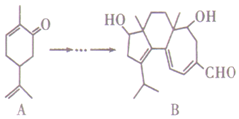 如图,有机物B对治疗神经系统疾病有着很好的疗效,可用有机物A经过多步反应合成.下列说法不正确的是( )
如图,有机物B对治疗神经系统疾病有着很好的疗效,可用有机物A经过多步反应合成.下列说法不正确的是( )| A. | A的化学式为C10H14O | |
| B. | 与A互为同分异构体,分子中有4种不同化学环境的氢原子的酚类化合物共有4种 | |
| C. | A和B均能使酸性KMnO4溶液褪色 | |
| D. | B可以发生加成反应、消去反应和氧化反应 |
| A. | 乙烷和乙烯 | B. | 乙酸和四氯化碳 | C. | 苯和聚乙烯 | D. | 丙烯和乙炔 |
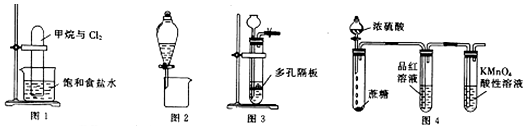
| A. | 图1可实现甲烷与氯气在光照条件下的置换反应 | |
| B. | 图2可分离CH3CH3OH和CH3COOC2H5的混合液 | |
| C. | 图3可用于锌粒与稀硝酸反应制备氢气 | |
| D. | 图4可说明浓H2SO4具有脱水性和强氧化性,SO2具有漂白性和还原性 |
| A. | NH4HCO3受热易分解,可用作氮肥 | |
| B. | Na2CO3具有碱性,可用作胃酸中和剂 | |
| C. | SiO2易传导光信号,可用作光导纤维 | |
| D. | Ca(ClO)2在空气中不稳定,可用于漂白纸张 |
| A. | c(OH-)减小 | B. | c(A- )增大 | C. | $\frac{c({H}^{+})}{c(HA)}$增大 | D. | pH减小 |
| A. | 在家用燃煤中适量的生石灰能有效减少二氧化硫的排放量 | |
| B. | 利用清洁能源如太阳能、潮汐能、风能来发电 | |
| C. | 大量排放 SO2或 CO2 都会导致酸雨的形成 | |
| D. | 采用纳米二氧化钛光触媒技术,将汽车尾气中的 NO 和 CO 转化为无害气体 |
| A. | 植物通过光合作用,将太阳能转化为生物质能 | |
| B. | 在农村推广建造沼气池,是对生物质能的有效利用 | |
| C. | 天然气的主要成分是甲烷,是一种可再生的清洁能源 | |
| D. | 氢能是重要的清洁能源,在蓝绿藻、微生物和太阳光作用下使水分解制氢是目前科学家研究的新方法之一 |