题目内容
18.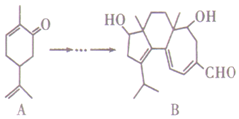 如图,有机物B对治疗神经系统疾病有着很好的疗效,可用有机物A经过多步反应合成.下列说法不正确的是( )
如图,有机物B对治疗神经系统疾病有着很好的疗效,可用有机物A经过多步反应合成.下列说法不正确的是( )| A. | A的化学式为C10H14O | |
| B. | 与A互为同分异构体,分子中有4种不同化学环境的氢原子的酚类化合物共有4种 | |
| C. | A和B均能使酸性KMnO4溶液褪色 | |
| D. | B可以发生加成反应、消去反应和氧化反应 |
分析 由有机物结构简式确定有机物的分子式,A含有碳碳双键、羰基,B分子含有碳碳双键、醛基以及羟基,结合烯烃、醛以及醇的性质确定有机物的性质,结合同分异构体的定义解答该题.
解答 解:A.根据有机物的结构简式并结合键线式的结构特点可知,A的化学式为C10H14O,故A正确;
B.与A互为同分异构体,分子中有4种不同化学环境的氢原子的酚类化合物,说明分子中含有酚羟基.如果苯环上只有2个取代基,则另一个取代基是丁基.要满足分子中有4种不同化学环境的氢原子,则该取代基应该是-C(CH3)3,且与酚羟基是对位的;如果含有3个取代基,则另外2个取代基是乙基,与酚羟基的位置是邻位时等效氢原子最少,有5种氢原子;如果是4个甲基与1个酚羟基,可满足分子中有4种不同化学环境的氢原子,所以可能的结构简式有2种,故B错误;
C.A和B中均含有碳碳双键,均能使酸性KMnO4溶液褪色,故C正确;
D.B中含有碳碳双键、醛基以及羟基,且与羟基相连的碳原子的邻位碳原子上含有氢原子,所以A可以发生加成反应、氧化反应、消去反应,故D正确;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重醇、烯烃性质及同分异构体的考查,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列有关性质的比较,不能用元素周期律解释的是( )
| A. | 酸性:H2SO4>H3PO4 | B. | 热稳定性:Na2CO3>NaHCO3 | ||
| C. | 碱性:NaOH>Mg(OH)2 | D. | 非金属性:Cl>Br |
6.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 将硫的酒精溶液滴入一定量的热水中得微蓝色透明液体,用激光笔照射微蓝色透明液体,有光亮的通路 | 微蓝色透明液体为胶体 |
| B | 室温下,向10mL 0.2mol•L-1 AgNO3溶液中滴入2滴0.1 mol•L-1 NaCl溶液,产生白色沉淀后,再滴加2滴0.1mol•L-1NaI溶液,生成黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 向某溶液中加入BaCl2溶液,无明显现象,再加稀盐酸,有无色且能使澄清石灰水变浑浊的气体产生 | 溶液中一定含HCO3- |
| D | 取少量CH3CH2Br与NaOH溶液共热,冷却后滴加AgNO3溶液,无淡黄色沉淀出现 | CH3CH2Br没有水解 |
| A. | A | B. | B | C. | C | D. | D |
13.下列指定反应的离子方程式正确的是( )
| A. | 铝溶于NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| B. | 铜丝插入Fe2(SO4)3溶液中:Cu+Fe3+═Cu2++Fe2+ | |
| C. | 向FeBr2溶液中通入过量Cl2:2Br-+Cl2═Br2+2Cl- | |
| D. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3+CO32- |
3.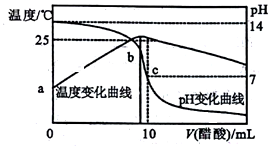 在某温度时,将nmol•L-1醋酸溶液滴入10mL1.0mol•L-1NaOH溶液中,溶液pH和温度随加入醋酸溶液体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将nmol•L-1醋酸溶液滴入10mL1.0mol•L-1NaOH溶液中,溶液pH和温度随加入醋酸溶液体积变化曲线如图所示,下列有关说法正确的是( )
 在某温度时,将nmol•L-1醋酸溶液滴入10mL1.0mol•L-1NaOH溶液中,溶液pH和温度随加入醋酸溶液体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将nmol•L-1醋酸溶液滴入10mL1.0mol•L-1NaOH溶液中,溶液pH和温度随加入醋酸溶液体积变化曲线如图所示,下列有关说法正确的是( )| A. | 水的电离程度:c>b | B. | a点Kw比b点大 | ||
| C. | n>1.0 | D. | c点:Ka(CH3COOH)=$\frac{10}{10n+1}$×10-8 |
10.下列离子方程式书写正确的是( )
| A. | 碳酸钙与醋酸反应:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- | |
| B. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| C. | NaHCO3溶液显碱性:HCO3-+H2O═CO32-+H3O+ | |
| D. | 碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
7.元素①~⑩在周期表中的位置如表所示,试回答下列问题.
(1)上述10种元素中,化学性质最不活泼的是Ar(填元素符号,下同);与水反应最激烈的金属元素是K.
(2)元素 ②的气态氢化物的分子式是NH3;上述10种元素中,其最高价氧化物对应水化物的酸性最强的物质是HClO4(填化学式).
(3)用电子式表示元素③与④形成1:2型化合物的形成过程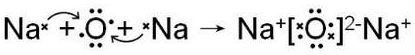 .
.
(4)①②⑤元素的原子半径由小到大的顺序为N、C、Mg(用元素符号表示);③⑦⑩元素的气态氢化物的稳定性由强到弱的顺序为H2O、HCl、HBr(用氢化物的化学式表示).
(5)④和⑥两元素的最高价氧化物对应的水化物相互反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O.
周期 族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)元素 ②的气态氢化物的分子式是NH3;上述10种元素中,其最高价氧化物对应水化物的酸性最强的物质是HClO4(填化学式).
(3)用电子式表示元素③与④形成1:2型化合物的形成过程
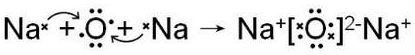 .
.(4)①②⑤元素的原子半径由小到大的顺序为N、C、Mg(用元素符号表示);③⑦⑩元素的气态氢化物的稳定性由强到弱的顺序为H2O、HCl、HBr(用氢化物的化学式表示).
(5)④和⑥两元素的最高价氧化物对应的水化物相互反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O.
20.下列实验方案能达到实验目的是( )
| 选项 | 实验H的 | 实验方案 |
| A | 证明Mg(OH)2沉淀可以转化为 Fe(OH)3 | 向2mL1mol/LNaOH溶液中先加入3滴1mol/LMgCl2溶液,再加入3滴1mol/LFeCl3溶液 |
| B | 比较氯和碳的非属性强弱 | 将盐酸滴入碳酸氢钠溶液中 |
| C | 验证电解饱和食盐水阳极有氯气生成 | 以铁为电极电解饱和食盐水,并将阳极生成的气体通入淀粉-KI溶液 |
| D | 比较铜和镁的金属活动性强弱 | 用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合溶液 |
| A. | A | B. | B | C. | C | D. | D |
 .己知NF3与NH3具有相同的空间构型,但NF3不易与Cu2+形成配离子,其原因是F的电负性比N大,N-F成键电子对偏向F,导致NF3中氮原子核对其孤电子对的吸引能力增强,难以形成配位键.
.己知NF3与NH3具有相同的空间构型,但NF3不易与Cu2+形成配离子,其原因是F的电负性比N大,N-F成键电子对偏向F,导致NF3中氮原子核对其孤电子对的吸引能力增强,难以形成配位键.