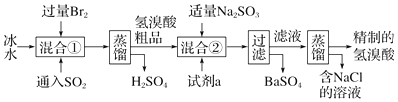
题目内容
2.下列有关实验原理、装置、操作或结论的描述中,正确的是( )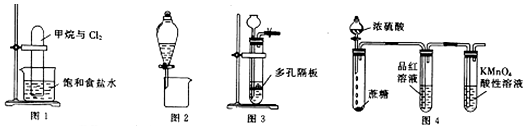
| A. | 图1可实现甲烷与氯气在光照条件下的置换反应 | |
| B. | 图2可分离CH3CH3OH和CH3COOC2H5的混合液 | |
| C. | 图3可用于锌粒与稀硝酸反应制备氢气 | |
| D. | 图4可说明浓H2SO4具有脱水性和强氧化性,SO2具有漂白性和还原性 |
分析 A.光照下甲烷与氯气发生取代反应;
B.CH3CH3OH和CH3COOC2H5的混合液互溶、不分层;
C.锌粒与稀硝酸发生氧化还原反应不生成氢气;
D.浓硫酸具有脱水性,使蔗糖碳化后,C与浓硫酸反应生成二氧化硫,品红、高锰酸钾均褪色.
解答 解:A.光照下甲烷与氯气发生取代反应,则图中装置可实现甲烷与氯气在光照条件下的取代反应生成氯代烃和HCl,故A错误;
B.CH3CH3OH和CH3COOC2H5的混合液互溶、不分层,不能利用图中分液漏斗分离,故B错误;
C.锌粒与稀硝酸发生氧化还原反应不生成氢气,应选Zn与稀硫酸反应,故C错误;
D.浓硫酸具有脱水性,使蔗糖碳化后,C与浓硫酸发生氧化还原反应生成二氧化硫,体现浓硫酸的强氧化性,图中品红、高锰酸钾均褪色,品红褪色与二氧化硫的漂白性有关,高锰酸钾褪色与二氧化硫的还原性有关,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、物质的性质、混合物分离提纯、实验技能等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
17.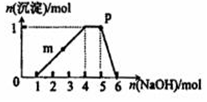 某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-等离子.向该溶液中滴加NaOH溶液,生成沉淀的物质的量变化曲线如右图所示.下列有关判断正确的是( )
某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-等离子.向该溶液中滴加NaOH溶液,生成沉淀的物质的量变化曲线如右图所示.下列有关判断正确的是( )
 某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-等离子.向该溶液中滴加NaOH溶液,生成沉淀的物质的量变化曲线如右图所示.下列有关判断正确的是( )
某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-等离子.向该溶液中滴加NaOH溶液,生成沉淀的物质的量变化曲线如右图所示.下列有关判断正确的是( )| A. | m点处反应:H++OH-═H2O | |
| B. | p点:c(NH4+)>c(OH-)>c(H+) | |
| C. | 若取原溶液做焰色反应实验,焰色应为黄色 | |
| D. | 原溶液中存在的主要离子:n(H+)=n(NH4+)=n(Al3+) |
13.下列指定反应的离子方程式正确的是( )
| A. | 铝溶于NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| B. | 铜丝插入Fe2(SO4)3溶液中:Cu+Fe3+═Cu2++Fe2+ | |
| C. | 向FeBr2溶液中通入过量Cl2:2Br-+Cl2═Br2+2Cl- | |
| D. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3+CO32- |
10.下列离子方程式书写正确的是( )
| A. | 碳酸钙与醋酸反应:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- | |
| B. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| C. | NaHCO3溶液显碱性:HCO3-+H2O═CO32-+H3O+ | |
| D. | 碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
17.部分短周期元素的性质或原子结构如表所示.下列叙述不正确的是( )
| 元素代号1 | 元素的性质或原子结构 |
| W | M层上的电子数为4 |
| X | 常温下,其单质为双原子分子,其氢化物的水溶液呈碱性 |
| Y | L层电子数为次外层电子数的3倍 |
| Z | 元素最高正价是+7价 |
| A. | 化合物WY2不溶于水 | |
| B. | 原子半径:W>X>Y | |
| C. | 最高价氧化物对应水化物的酸性:W<Z | |
| D. | 由X、Y和氢三种元素形成的所有化合物中只含共价键 |
7.元素①~⑩在周期表中的位置如表所示,试回答下列问题.
(1)上述10种元素中,化学性质最不活泼的是Ar(填元素符号,下同);与水反应最激烈的金属元素是K.
(2)元素 ②的气态氢化物的分子式是NH3;上述10种元素中,其最高价氧化物对应水化物的酸性最强的物质是HClO4(填化学式).
(3)用电子式表示元素③与④形成1:2型化合物的形成过程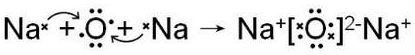 .
.
(4)①②⑤元素的原子半径由小到大的顺序为N、C、Mg(用元素符号表示);③⑦⑩元素的气态氢化物的稳定性由强到弱的顺序为H2O、HCl、HBr(用氢化物的化学式表示).
(5)④和⑥两元素的最高价氧化物对应的水化物相互反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O.
周期 族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)元素 ②的气态氢化物的分子式是NH3;上述10种元素中,其最高价氧化物对应水化物的酸性最强的物质是HClO4(填化学式).
(3)用电子式表示元素③与④形成1:2型化合物的形成过程
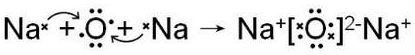 .
.(4)①②⑤元素的原子半径由小到大的顺序为N、C、Mg(用元素符号表示);③⑦⑩元素的气态氢化物的稳定性由强到弱的顺序为H2O、HCl、HBr(用氢化物的化学式表示).
(5)④和⑥两元素的最高价氧化物对应的水化物相互反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O.
14.下列装置(部分夹持仪器略去)或操作正确的是( )
| A. | 除去乙块中的H2S | B. | 检验是否存在苯酚 | ||
| C. |  银镜反应 | D. |  中和滴定 |
4.化学与生产、生活、社会发展等息息相关.下列说法正确的是( )
| A. | 利用植物油的氧化反应可获得人造脂肪 | |
| B. | 干馏煤可以得到甲烷、苯和氨等重要化工原料 | |
| C. | 工业生产玻璃、水泥和陶瓷,均需用石灰石作原料 | |
| D. | 明矾和“84”消毒液均可用于自来水的杀菌消毒 |