题目内容
11.在100mL(NH4)2SO4和Al2(SO4)3的混合溶液中,加入足量的BaCl2的溶液,生成9.32g沉淀,再加入足量NaOH溶液并加热,生成NH4448mL(标准状况),则原溶液中Al3+的浓度为( )| A. | 0.10mol/L | B. | 0.20mol/L | C. | 0.30mol/L | D. | 0.40mol/L |
分析 根据SO42-+Ba2+═BaSO4↓计算溶液中的SO42-离子的物质的量,根据NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O计算NH4+的物质的量,再利用电荷守恒来计算原溶液中的Al3+的物质的量,最后根据c=$\frac{n}{V}$计算原溶液中Al3+的浓度.
解答 解:在100mL(NH4)2SO4和Al2(SO4)3的混合溶液中,加入足量的BaCl2的溶液,生成9.32g沉淀,则n(BaSO4)=$\frac{9.32g}{233g/mol}$=0.04mol,
则SO42-+Ba2+═BaSO4↓
0.04mol 0.04mol
由加入足量强碱并加热可得到 NH3为448mL(标准状况),则n(NH3)=$\frac{0.448L}{22.4L/mol}$=0.02mol,
设原溶液中的Al3+浓度为x,由电荷守恒可知,
3x+0.02mol×1=0.04mol×2,
解得:x=0.02mol,
则原溶液中铝离子的浓度为:c(Al3+)=$\frac{0.02mol}{0.1L}$=0.20mol/L,
故选B.
点评 本题考查物质的量浓度的计算,题目难度不大,明确发生的离子反应及溶液不显电性是解答本题的关键,并熟悉浓度的计算公式来解答即可,试题培养了学生的化学计算能力.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
15.下列说法中正确的是( )
| A. | 用湿润的pH试纸测定某待测液的pH,数值一定偏大 | |
| B. | 25℃时,pH=2的一元酸溶液与pH=12的一元碱溶液等体积混合,所得溶液pH=7 | |
| C. | 在(NH4)2Fe(SO4)2溶液中,c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | |
| D. | pH相同的NaOH和CH3COONa两种稀溶液,若稀释后,pH仍相同,则稀释的倍数相同 |
16. 在3支试管中分别放有:①1mL乙酸乙酯和3mL水 ②1mL硝基苯和3mL水 ③1mL乙酸和3mL水,图中三支试管从左到右的排列顺序为( )
在3支试管中分别放有:①1mL乙酸乙酯和3mL水 ②1mL硝基苯和3mL水 ③1mL乙酸和3mL水,图中三支试管从左到右的排列顺序为( )
 在3支试管中分别放有:①1mL乙酸乙酯和3mL水 ②1mL硝基苯和3mL水 ③1mL乙酸和3mL水,图中三支试管从左到右的排列顺序为( )
在3支试管中分别放有:①1mL乙酸乙酯和3mL水 ②1mL硝基苯和3mL水 ③1mL乙酸和3mL水,图中三支试管从左到右的排列顺序为( )| A. | ②③① | B. | ①②③ | C. | ①③② | D. | ②①③ |
13.0.2mo1•L-1的NH4Cl溶液与0.1mol•L-1NaOH溶液等体积混合.下列判断正确的是( )
| A. | 所得溶液中存在等式:c(NH4+)+c(Na+)=c(Cl-)+c(OH-) | |
| B. | 所得溶液显碱性,且c(NH4+)<c(NH3•H2O) | |
| C. | 溶液中存在等式:c(NH4+)+c(NH3•H2O)=c(Cl-) | |
| D. | 溶液中c(Na+)=0.1mol•L-1 |
16.在冰醋酸、葡萄糖、甲酸甲酯的混合物中,含碳的质量分数为( )
| A. | 30% | B. | 40% | C. | 50% | D. | 无法确定 |
3.从柑橘中可提炼得到1,8-萜二烯: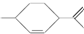 ,下列有关该有机物的说法中不正确的是( )
,下列有关该有机物的说法中不正确的是( )
 ,下列有关该有机物的说法中不正确的是( )
,下列有关该有机物的说法中不正确的是( )| A. | 分子式为C10H18 | |
| B. | 常温下呈液态,难溶于水 | |
| C. | 1 mol该有机物最多能和2mol H2发生加成反应 | |
| D. | 该有机物能与溴水发生取代反应 |
1.B3N3H6的结构和性质与苯相似,因而称为无机苯.下列关于无机苯的叙述不正确的是( )
| A. | 无机苯中各原子在同一平面上 | |
| B. | 无机苯为实际上是有机物 | |
| C. | 在一定条件下,无机苯可发生取代反应和加成反应 | |
| D. | 无机苯不能使酸性KMnO4溶液褪色 |

 )发生缩聚反应产物的结构简式为
)发生缩聚反应产物的结构简式为 ;
; 有机物Ⅱ的结构简式为CH3C≡CCH=CHCH2CH3;A、B可以发生类似①的反应生成有机物Ⅰ,则该反应的化学方程式为CH3C≡CH+CH3CH2CHO$\stackrel{催化剂}{→}$CH3C≡CCH(OH)CH2CH2CH3.
有机物Ⅱ的结构简式为CH3C≡CCH=CHCH2CH3;A、B可以发生类似①的反应生成有机物Ⅰ,则该反应的化学方程式为CH3C≡CH+CH3CH2CHO$\stackrel{催化剂}{→}$CH3C≡CCH(OH)CH2CH2CH3.