题目内容
6.试比较下列三组△H的大小(填“>”、“<”或“=”)A.A(g)+B(g)=C(g)△H1<0 A(g)+B(g)=C(l)△H2<0 则△H1>△H2
B.S(g)+O2(g)=SO2(g)△H1<0 S (s)+O2(g)=SO2(g)△H2<0 则△H1<△H2
C.C(s)+O2(g)=CO2(g)△H1<0 C(s)+$\frac{1}{2}$O2(g)=CO(g)△H2<0 则△H1<△H2.
分析 同种物质气态变为液态放出热量,根据盖斯定律和物质的不同聚集状态判断反应热的大小.
解答 解:A.物质的聚集状态不同,放出的热量不同,同种物质气态变为液态时放热,则有|△H1|<|△H2|,由于该反应为放热反应,△H<0,则△H1>△H2,故答案为:>;
B.S(g)变为S (s)放热,则S (g)燃烧放出的热量多,又燃烧为放热反应,△H<0,则△H1<△H2,故答案为:<;
C.等量的C(s)燃烧生成CO2(g),即充分燃烧时放出的热量多,又燃烧为放热反应,△H<0,则△H1<△H2,故答案为:<.
点评 本题考查反应热的大小比较,注意比较焓变时不能忽略“+”“-”,掌握基础是解题关键,题目较简单.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
10.在一定条件下,下列物质不能与二氧化硅反应的是( )
①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸 ⑤硝酸 ⑥氢氧化钠 ⑦水.
①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸 ⑤硝酸 ⑥氢氧化钠 ⑦水.
| A. | ③⑤⑦ | B. | ⑤⑦ | C. | ③⑤ | D. | ⑤ |
11.下列说法正确的是( )
①乙二酸二乙酯和乙二酸乙二酯互为同分异构体:
②碳酸钠、氢氧化钡、氯化铵、过氧化钠都属于离子化合物
③蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电解质和弱电解质
④冰醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
⑤氯水、水银、福尔马林、聚乙烯均为混合物
⑥盐酸属于混合物,而液氯、冰醋酸均属于纯净物.
①乙二酸二乙酯和乙二酸乙二酯互为同分异构体:
②碳酸钠、氢氧化钡、氯化铵、过氧化钠都属于离子化合物
③蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电解质和弱电解质
④冰醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
⑤氯水、水银、福尔马林、聚乙烯均为混合物
⑥盐酸属于混合物,而液氯、冰醋酸均属于纯净物.
| A. | ①④⑥ | B. | ④⑤⑥ | C. | ②③④ | D. | ②④⑥ |
8.在CaCO3饱和溶液中,加入Na2CO3固体,达到平衡时( )
| A. | c(Ca2+)=c(CO32-) | |
| B. | c(Ca2+)=c(CO32-)=$\sqrt{{K}_{sp}CaC{O}_{3}}$ | |
| C. | c(Ca2+)≠c(CO32-),c(Ca2+)•c(CO32-)=Ksp(CaCO3) | |
| D. | c(Ca2+)≠c(CO32-),c(Ca2+)•c(CO32-)≠Ksp(CaCO3) |
11.在100mL(NH4)2SO4和Al2(SO4)3的混合溶液中,加入足量的BaCl2的溶液,生成9.32g沉淀,再加入足量NaOH溶液并加热,生成NH4448mL(标准状况),则原溶液中Al3+的浓度为( )
| A. | 0.10mol/L | B. | 0.20mol/L | C. | 0.30mol/L | D. | 0.40mol/L |
15.下列关于物质鉴别的方法中不正确的是( )
| A. | 可用酸性高锰酸钾溶液鉴别甲烷和乙烯气体 | |
| B. | 可用淀粉溶液鉴别KI和KBr溶液 | |
| C. | 可用澄清石灰水检验H2和CH4的燃烧产物 | |
| D. | 可用溴水鉴别苯和四氯化碳 |
16.下列有机物的一氯代物是四种的是( )
①异戊烷 ②甲苯 ③2-丁烯 ④对二甲苯.
①异戊烷 ②甲苯 ③2-丁烯 ④对二甲苯.
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
 ,Y的空间构型为V形.
,Y的空间构型为V形.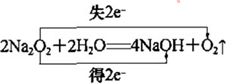 .
.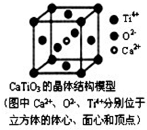 下列关于晶体的说法正确的组合是( )
下列关于晶体的说法正确的组合是( )