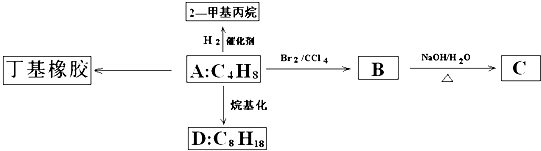
题目内容
下列解释实验现象的反应方程式不正确的是( )
| A、SO2通入到滴加酚酞的NaOH溶液中,红色变浅:SO2+2NaOH=Na2SO3+H2O |
| B、用Na2S处理含Hg2+废水:Hg2++S2-═HgS↓ |
| C、等浓度的NH4Al(SO4)2溶液与Ba(OH)2溶液以1:2体积比混合出现白色沉淀:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3?H2O |
| D、用Na2CO3溶液处理水垢中的CaSO4:Ca2++CO32-═CaCO3↓ |
考点:离子方程式的书写,化学方程式的书写
专题:化学用语专题
分析:A.二氧化硫与氢氧化钠溶液反应生成亚硫酸钠和水,碱性减弱,红色变浅;
B.硫离子与汞离子反应生成硫化汞沉淀;
C.铵根离子结合氢氧根能力大于氢氧化铝,铵根离子优先反应,氢氧化铝不溶解;
D.硫酸钙不能拆开,需要保留化学式.
B.硫离子与汞离子反应生成硫化汞沉淀;
C.铵根离子结合氢氧根能力大于氢氧化铝,铵根离子优先反应,氢氧化铝不溶解;
D.硫酸钙不能拆开,需要保留化学式.
解答:
解:A.SO2通入到滴加酚酞的NaOH溶液中,红色变浅,二氧化硫与氢氧化钠反应生成亚硫酸钠和水,反应的化学方程式为:SO2+2NaOH=Na2SO3+H2O,故A正确;
B.用Na2S处理含Hg2+废水,反应生成硫化汞沉淀,反应的离子方程式为:Hg2++S2-═HgS↓,故B正确;
C.等浓度的NH4Al(SO4)2溶液与Ba(OH)2溶液以1:2体积比混合,铵根离子结合氢氧根离子能力大于氢氧化铝,会出现白色沉淀,反应的离子方程式为:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3?H2O,故C正确;
D.Na2CO3溶液处理水垢中的CaSO4,硫酸钙不能拆开,正确的离子方程式为:CaSO4+CO32-═CaCO3+SO42-,故D错误;
故选D.
B.用Na2S处理含Hg2+废水,反应生成硫化汞沉淀,反应的离子方程式为:Hg2++S2-═HgS↓,故B正确;
C.等浓度的NH4Al(SO4)2溶液与Ba(OH)2溶液以1:2体积比混合,铵根离子结合氢氧根离子能力大于氢氧化铝,会出现白色沉淀,反应的离子方程式为:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3?H2O,故C正确;
D.Na2CO3溶液处理水垢中的CaSO4,硫酸钙不能拆开,正确的离子方程式为:CaSO4+CO32-═CaCO3+SO42-,故D错误;
故选D.
点评:本题考查了离子方程式、化学方程式的正误判断,为高考中的高频题,属于中等难度的试题,注意掌握离子方程式、化学方程式的书写原则,如:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等).

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法正确的是( )
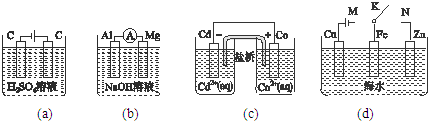

| A、图(a)中,随着电解的进行,溶液中H+的浓度越来越小 |
| B、图(b)中,Mg电极作电池的负极 |
| C、图(c)中,发生的反应为Co+Cd2+=Cd+Co2+ |
| D、图(d)中,K分别与M、N连接时,Fe电极均受到保护 |
设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A、1 mol NaHSO4晶体中离子总数为2NA |
| B、4.4 g 14CO2含中子数为2.4NA |
| C、0.1 L 3 mol?L-1的NH4NO3溶液中含有的NH4+数目为0.3NA |
| D、1 mol Fe在氧气中充分燃烧失去的电子数为3NA |
下列离子方程式中正确的是( )
| A、氯化亚铁溶液与过氧化钠2:1反应:6Fe2++3 Na2O2+6 H2O=4Fe(OH)3↓+6 Na++2Fe3+ |
| B、向氧化铁中加入氢碘酸发生反应:Fe2O3+6H++6 I -=2Fe2++3I2+3H2O |
| C、双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+O2↑+2 H2O |
| D、向银氨溶液中加入盐酸:[Ag(NH3)2]++OH-+3H+=Ag++2NH4++H2O |
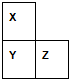 X、Y、Z、W、R是短周期元素,X、Y、Z在周期表中的位置如图所示,其中Z的族序数与周期序数之差为4,W最高价氧化物水化物的阴、阳离子电子数相等,R与W同周期,R最高价氧化物的水化物与W、Y最高价氧化物的水化物均能反应.
X、Y、Z、W、R是短周期元素,X、Y、Z在周期表中的位置如图所示,其中Z的族序数与周期序数之差为4,W最高价氧化物水化物的阴、阳离子电子数相等,R与W同周期,R最高价氧化物的水化物与W、Y最高价氧化物的水化物均能反应.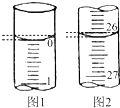 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白: