题目内容
有两种体积相同的某植物的营养液,其配方如下表所示:对于两种营养液的成分,下列说法中,正确的是( )
| KCl | K2SO4 | ZnSO4 | ZnCl2 | |
| 1 | 0.3mol | 0.2mol | 0.1mol | - |
| 2 | 0.1mol | 0.3mol | - | 0.1mol |
| A、只有n(K+)相同 |
| B、只有n(Cl-)相同 |
| C、各离子的物质的量均不同 |
| D、各离子的物质的量完全相同 |
考点:物质的量的相关计算
专题:
分析:根据两种溶液中各种离子的物质的量是否相等判断两种溶液的成分是否相同,如果两种溶液中各种离子的物质的量都相等,则两种溶液的成分相同.
解答:
解:①中n(K+)=0.3mol+0.2mol×2=0.7mol,n(SO42- )=0.2 mol+0.1mol=0.3mol,n (Zn2+)=0.1 mol,(Cl-)=0.3 mol,
②中n(K+)=0.1mol+0.3mol×2=0.7mol,n(SO42- )=0.3mol,n (Zn2+)=0.1 mol,(Cl-)=0.1mol+0.1mol×2=0.3 mol,
所以①和②中各种离子的物质的量:n(K+)=0.7 mol,n(SO42- )=0.3 mol,n (Zn2+)=0.1 mol,n(Cl-)=0.3 mol,所以成分相同,
故选D.
②中n(K+)=0.1mol+0.3mol×2=0.7mol,n(SO42- )=0.3mol,n (Zn2+)=0.1 mol,(Cl-)=0.1mol+0.1mol×2=0.3 mol,
所以①和②中各种离子的物质的量:n(K+)=0.7 mol,n(SO42- )=0.3 mol,n (Zn2+)=0.1 mol,n(Cl-)=0.3 mol,所以成分相同,
故选D.
点评:本题综合考查物质的量,为高频考点,侧重学生的分析能力和计算能力的考查,注意物质的构成特点,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
将0.1mol?L-1的醋酸溶液加水稀释,则( )
| A、中和此溶液所需的0.1 mol?L-1 NaOH溶液的体积增加 |
| B、c(CH3COOH)减小,平衡向电离方向移动,c(CH3COO-)增大 |
| C、平衡向电离方向移动,c(CH3COOH)、c(H+)、c(OH-)、c(CH3COO-)均减小 |
| D、电离程度增大,由CH3COOH电离出的n(H+)变大 |
同主族元素所形成的同一类化合物,往往其结构和性质相似.化合物PH4I是一种无色晶体,下列对它的描述错误的是( )
| A、是一种共价化合物 |
| B、可由PH3与HI化合生成 |
| C、在加热的条件下,可以分解产生有色气体 |
| D、能跟碱反应放出PH3 |
短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13.X的原子半径比Y的小,X与W同主族,Z是地壳中含量最高的元素.下列说法正确的( )
| A、原子半径的大小顺序:r(Y)>r(Z)>r(W) |
| B、只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
| C、元素Y的简单气态氢化物的热稳定性比Z的强 |
| D、元素Z、W的简单离子的电子层结构不同 |
设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A、1 mol NaHSO4晶体中离子总数为2NA |
| B、4.4 g 14CO2含中子数为2.4NA |
| C、0.1 L 3 mol?L-1的NH4NO3溶液中含有的NH4+数目为0.3NA |
| D、1 mol Fe在氧气中充分燃烧失去的电子数为3NA |
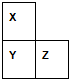 X、Y、Z、W、R是短周期元素,X、Y、Z在周期表中的位置如图所示,其中Z的族序数与周期序数之差为4,W最高价氧化物水化物的阴、阳离子电子数相等,R与W同周期,R最高价氧化物的水化物与W、Y最高价氧化物的水化物均能反应.
X、Y、Z、W、R是短周期元素,X、Y、Z在周期表中的位置如图所示,其中Z的族序数与周期序数之差为4,W最高价氧化物水化物的阴、阳离子电子数相等,R与W同周期,R最高价氧化物的水化物与W、Y最高价氧化物的水化物均能反应.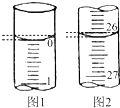 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白: