题目内容
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性、它们在酸性溶液中还原性强弱顺序为Cl-<H2O2<Fe2+<I-<SO2,则下列反应不能发生的是( )
| A、2Fe2++I2=2Fe3++2I- |
| B、2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
| C、SO2+I2+2H2O=H2SO4+2HI |
| D、H2O2+SO2=H2SO4 |
考点:氧化性、还原性强弱的比较
专题:氧化还原反应专题
分析:根据氧化还原反应中还原剂的还原性大于还原产物的还原性,利用酸性溶液中还原性强弱的顺序是Cl-<H2O2<Fe2+<I-<SO2,来判断反应能否发生.
解答:
解:A、2Fe2++I2=2Fe3++2I-因该反应中Fe元素的化合价升高,I元素的化合价降低,则Fe2+为还原剂,还原性强弱为I-<Fe2+,与已知的还原性强弱不一致,故A选;
B、2Fe3++SO2+2H2O=2Fe2++SO42-+4H+因该反应中S元素的化合价升高,Fe元素的化合价降低,则SO2为还原剂,还原性强弱为SO2>Fe2+,与已知的还原性强弱一致,故B不选;
C、SO2+I2+2H2O=H2SO4+2HI因该反应中S元素的化合价升高,I元素的化合价降低,则SO2为还原剂,还原性强弱为SO2>I-,与已知的还原性强弱一致,故C不选;
D、H2O2+SO2=H2SO4若该反应发生,O元素的化合价降低,S元素的化合价升高,则SO2为还原剂,还原性强弱为H2O2<SO2,与已知的还原性强弱一致,故D不选;
故选A.
B、2Fe3++SO2+2H2O=2Fe2++SO42-+4H+因该反应中S元素的化合价升高,Fe元素的化合价降低,则SO2为还原剂,还原性强弱为SO2>Fe2+,与已知的还原性强弱一致,故B不选;
C、SO2+I2+2H2O=H2SO4+2HI因该反应中S元素的化合价升高,I元素的化合价降低,则SO2为还原剂,还原性强弱为SO2>I-,与已知的还原性强弱一致,故C不选;
D、H2O2+SO2=H2SO4若该反应发生,O元素的化合价降低,S元素的化合价升高,则SO2为还原剂,还原性强弱为H2O2<SO2,与已知的还原性强弱一致,故D不选;
故选A.
点评:本题考查学生利用已知的还原性强弱来判断化学反应的发生,学生应学会利用化合价来分析反应中的还原剂,并利用还原剂的还原性大于还原产物的还原性来解答即可,题目难度不大.

练习册系列答案
相关题目
同主族元素所形成的同一类化合物,往往其结构和性质相似.化合物PH4I是一种无色晶体,下列对它的描述错误的是( )
| A、是一种共价化合物 |
| B、可由PH3与HI化合生成 |
| C、在加热的条件下,可以分解产生有色气体 |
| D、能跟碱反应放出PH3 |
下列事实不能用勒夏特列原理解释的是( )
| A、黄绿色的氯水光照后颜色变浅 |
| B、NO2(g)+SO2(g)?SO3(g)+NO(g),对该平衡体系加压后颜色加深 |
| C、由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅 |
| D、在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去 |
短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13.X的原子半径比Y的小,X与W同主族,Z是地壳中含量最高的元素.下列说法正确的( )
| A、原子半径的大小顺序:r(Y)>r(Z)>r(W) |
| B、只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
| C、元素Y的简单气态氢化物的热稳定性比Z的强 |
| D、元素Z、W的简单离子的电子层结构不同 |
设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A、1 mol NaHSO4晶体中离子总数为2NA |
| B、4.4 g 14CO2含中子数为2.4NA |
| C、0.1 L 3 mol?L-1的NH4NO3溶液中含有的NH4+数目为0.3NA |
| D、1 mol Fe在氧气中充分燃烧失去的电子数为3NA |
下列根据反应原理设计的应用,不正确的是( )
| A、CO32-+H2O?HCO3-+OH- Na2CO3与Al2(SO4)3溶液混合作灭火剂 |
| B、Al3++3H2O?Al(OH)3+3H+ 明矾净水 |
| C、TiCl4+(x+2)H2O(过量)?TiO2?xH2O↓+4HCl 制备TiO2纳米粉 |
| D、SnCl2+H2O?Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入浓盐酸 |
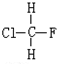 与
与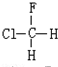
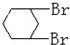 与
与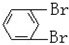
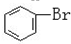 与
与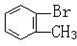
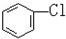 与
与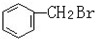
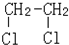 与CH3-CH2Cl.
与CH3-CH2Cl.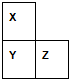 X、Y、Z、W、R是短周期元素,X、Y、Z在周期表中的位置如图所示,其中Z的族序数与周期序数之差为4,W最高价氧化物水化物的阴、阳离子电子数相等,R与W同周期,R最高价氧化物的水化物与W、Y最高价氧化物的水化物均能反应.
X、Y、Z、W、R是短周期元素,X、Y、Z在周期表中的位置如图所示,其中Z的族序数与周期序数之差为4,W最高价氧化物水化物的阴、阳离子电子数相等,R与W同周期,R最高价氧化物的水化物与W、Y最高价氧化物的水化物均能反应.