题目内容
17.中科院大连化学物理研究所的“煤基甲醇制取低碳烯烃技术(简称DMTO)”荣获2014年度国家技术发明一等奖.DMTO技术主要包括煤的气化、液化、烯烃化三个阶段,相关反应的热化学方程式如下:(i) 煤气化制合成气:C(s)+H2O(g)?CO(g)+H2(g)
(ii) 煤液化制甲醇:CO(g)+2H2(g)?CH3OH(g)
(iii)甲醇制取低碳烯烃:2CH3OH(g)?C2H4(g)+2H2O(g)△H=-11.72kJ•mol-1…(a)
3CH3OH(g)?C3H6(g)+3H2O(g)△H=-30.98kJ•mol-1…(b)
回答下列问题:
(1)已知:C(s)+CO2(g)═2CO(g)△H=+172.5kJ•mol-1,
CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.0kJ•mol-1
反应(i)能自发进行的条件是高温(填“高温”、“低温”或“任何温度”).
(2)反应(ii)中以氢碳[n(H2):n(CO)]投料比为2制取甲醇,温度、压强与CO的平衡转化率关系如图1.
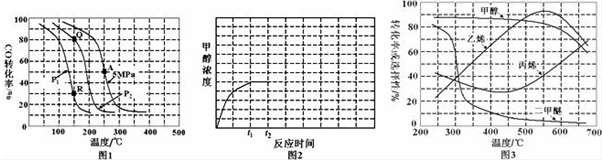
①对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则A点时反应(ii)的Kp=0.16(保留两位有效数字,分压=总压×物质的量分数).
②比较P1小于P2,Kp(Q)等于Kp(R)(填“大于”、“小于”或“等于”).
③工业上常以铜基催化剂,压强5MPa,温度275℃下发生反应(ii),CO转化率可达到40%左右.为提高CO转化率除了可以适当改变反应温度和压强外,还可以采取的措施有升高温度、增大压强(写出2个).
④若反应(ii)在恒容密闭容器内进行,T1温度下甲醇浓度随时间变化曲线如图2所示;不改变其他条件,假定t2时刻迅速降温到T2,t3时刻体系重新达到平衡.试在图中画出t2时刻后甲醇浓度随时间变化趋势图(在图2中标出t3).
(3)烯烃化阶段:在常压和某催化剂作用下,甲醇的平衡转化率及乙烯、丙烯等物质的选择性(指除了水蒸气以外的产物中乙烯、丙烯等物质的物质的量分数)与反应温度之间的关系如图3.为尽可能多地获得乙烯,控制反应温度为550℃的理由是550℃时甲醇的平衡转化率仍处于较高水平且产物中乙烯的物质的量分数最大.
分析 (1)已知:①C(s)+CO2(g)═2CO(g)△H=+172.5kJ•mol-1,
②CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.0kJ•mol-1,
根据盖斯定律可知①+②得C(s)+H2O(g)?CO(g)+H2(g)△H=+172.5kJ•mol-1-41.0kJ•mol-1=+131.5kJ•mol-1>0,反应(i)△S>0,结合△H-T△S<0判断;
(2)①A点CO的转化率为0.5,假设加入1molCO、2molH2,则
CO(g)+2H2(g)?CH3OH(g)
初始:1mol 2mol 0
转化:0.5mol 1mol 0.5mol
平衡:0.5mol 1mol 0.5mol
p(CO)=5MPa×$\frac{0.5mol}{0.5mol+1mol+0.5mol}$=0.75MPa,
p(H2)=5MPa×$\frac{1mol}{0.5mol+1mol+0.5mol}$=2.5MPa,
p(CH3OH)=5MPa×$\frac{0.5mol}{0.5mol+1mol+0.5mol}$=0.75MPa,
结合平衡时p计算Kp;
②150℃时,Q点比R点对应的CO的转化率大,平衡正向移动CO的转化率增大,而压强增大,CO(g)+2H2(g)?CH3OH(g)的平衡正向移动,说明P1>P2;Kp只受温度的影响;
③A点对应的温度为250℃,CO的抓化率为50%,275℃下CO转化率可达到40%左右,说明升高温度,平衡逆向移动;增大压强,平衡正向移动;
④反应(ii)CO(g)+2H2(g)?CH3OH(g)△H<0,t2时降低温度,平衡正向移动,甲醇的浓度增大,直至t3时达到新的平衡时保持不变;
(3)为尽可能多地获得乙烯,要综合考虑甲醇的平衡转化率和乙烯的物质的量分数.
解答 解:(1)已知:①C(s)+CO2(g)═2CO(g)△H=+172.5kJ•mol-1,
②CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.0kJ•mol-1,
根据盖斯定律可知①+②得C(s)+H2O(g)?CO(g)+H2(g)△H=+172.5kJ•mol-1-41.0kJ•mol-1=+131.5kJ•mol-1>0,反应(i)△S>0,高温时G=△H-T△S<0反应自发,
故答案为:高温;
(2)①A点CO的转化率为0.5,假设加入1molCO、2molH2,则
CO(g)+2H2(g)?CH3OH(g)
初始:1mol 2mol 0
转化:0.5mol 1mol 0.5mol
平衡:0.5mol 1mol 0.5mol
p(CO)=5MPa×$\frac{0.5mol}{0.5mol+1mol+0.5mol}$=0.75MPa,
p(H2)=5MPa×$\frac{1mol}{0.5mol+1mol+0.5mol}$=2.5MPa,
p(CH3OH)=5MPa×$\frac{0.5mol}{0.5mol+1mol+0.5mol}$=0.75MPa,
Kp=$\frac{p(C{H}_{3}OH)}{p(CO){p}^{2}({H}_{2})}$=$\frac{0.75}{0.75×(2.5)^{2}}$=0.16,
故答案为:0.16;
②150℃时,Q点比R点对应的CO的转化率大,平衡正向移动CO的转化率增大,而压强增大,CO(g)+2H2(g)?CH3OH(g)的平衡正向移动,说明P1>P2;Kp只受温度的影响,Q点和R点对应的温度都是150℃,因此Kp(Q)=Kp(R),
故答案为:小于;等于;
③A点对应的温度为250℃,CO的抓化率为50%,275℃下CO转化率可达到40%左右,说明升高温度,平衡逆向移动,CO(g)+2H2(g)
故答案为:升高温度;增大压强;
④反应(ii)CO(g)+2H2(g)?CH3OH(g)△H<0,t2时降低温度,平衡正向移动,甲醇的浓度增大,直至t3时达到新的平衡时保持不变,对应的图象为 ,故答案为:
,故答案为: ;
;
(3)为尽可能多地获得乙烯,要综合考虑甲醇的平衡转化率和乙烯的物质的量分数,550℃时甲醇的平衡转化率仍处于较高水平,而且此温度下产物中乙烯的物质的量分数最大,
故答案为:550℃时甲醇的平衡转化率仍处于较高水平且产物中乙烯的物质的量分数最大.
点评 本题考查化学平衡的计算及浓度与时间曲线,为高频考点,把握平衡移动影响因素、平衡计算、盖斯定律及反应方向判断为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度中等.

| A. | 当电池正极消耗mg气体时,电解池阴极同时有mg气体生成 | |
| B. | 电解后c(Na+)与c(CO32-)的比值变小 | |
| C. | 电池中c(KOH)不变;电解池中溶液pH变大 | |
| D. | 电解后c(Na2CO3)不变 |
 某实验小组用0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液进行中和热的测定:
某实验小组用0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液进行中和热的测定:Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,则至少需要称量NaOH固体5.0g.
(2)从表图中选择称量NaOH固体所需要的仪器(填序号)abe.
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
(2)取50mL NaOH溶液和30mL硫酸进行实验,实验数据如下表.
①请填写下表中的空白:
| 实验次数 温度 | 起始温度t1/℃ | 终止温度t2/℃ | 平均温度差 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
 工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g);△H=+206kJ/mol,一定条件下向体积为1L的密闭容器中充入1mol CH4和1mol H2O,测得CH4(g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )
工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g);△H=+206kJ/mol,一定条件下向体积为1L的密闭容器中充入1mol CH4和1mol H2O,测得CH4(g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )| A. | 10min时用CH4表示的反应速率为0.075 mol•L-1•min-1 | |
| B. | 使用高效催化剂能够增大CO的产率 | |
| C. | 该条件下反应的平衡常数为0.1875 | |
| D. | 升高温度能使$\frac{c(C{H}_{4})}{c(CO)}$增大 |
| A. | 用丁达尔效应可鉴别FeCl3溶液和Fe(OH)3胶体 | |
| B. | 在某未知成分的溶液中滴入足量盐酸,如观察到无色无味的气体产生,且能使澄清石灰水变浑浊,即证明溶液中必定有CO32- | |
| C. | 向某无色溶液中加入BaCl2溶液,有白色沉淀出现,再加入稀盐酸,沉淀不消失,无法证明溶液一定含有SO42- | |
| D. | 氨气能使湿润的红色石蕊试纸变蓝,说明氨气的水溶液呈碱性 |
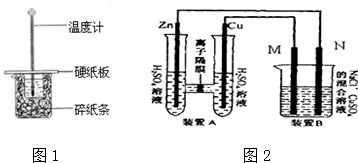
 50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置 中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.
50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置 中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.