题目内容
7.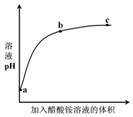 室温下,向0.01mol•L-1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵
室温下,向0.01mol•L-1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵溶液体积变化的曲线示意图如图所示.下列分析正确的是( )
| A. | a点,pH=2 | |
| B. | b点,c(CH3COO-)>c(NH4+) | |
| C. | c点,pH可能大于7 | |
| D. | ac段,溶液pH增大是CH3COOH?H++CH3COO-逆向移动的结果 |
分析 室温下,由于醋酸是弱电解质,溶液中存在电离平衡:CH3COOH?CH3COO-+H+,向0.01mol•L-1的醋酸溶液中滴入pH=7的醋酸铵溶液,导致c(CH3COO-)增大,则醋酸的电离平衡左移,即醋酸的电离被抑制.由于所得的溶液为CH3COOH和CH3COONH4的混合溶液,而CH3COONH4水解显中性,CH3COOH电离显酸性,故混合溶液的pH一直小于7.据此分析.
解答 解:A、由于醋酸是弱电解质,不能完全电离,故0.01mol/L的醋酸溶液中氢离子浓度小于0.01mol/L,则pH大于2,即a点的pH大于2,故A错误;
B、由于所得的溶液为CH3COOH和CH3COONH4的混合溶液,而CH3COONH4水解显中性,CH3COOH电离显酸性,故混合溶液的pH一直小于7,即b点溶液中的c(H+)>c(OH-),根据电荷守恒可知c(CH3COO-)>c(NH4+),故B正确;
C、由于所得的溶液为CH3COOH和CH3COONH4的混合溶液,而CH3COONH4水解显中性,CH3COOH电离显酸性,故混合溶液的pH一直小于7,即c点溶液的pH也一定小于7,故C错误;
D、在ab段,溶液的pH增大很快,这是由于醋酸是弱电解质,溶液中存在电离平衡:CH3COOH?CH3COO-+H+,向0.01mol•L-1的醋酸溶液中滴入pH=7的醋酸铵溶液,导致c(CH3COO-)增大,则醋酸的电离平衡左移,故溶液中的c(H+)减小,则溶液的pH增大;而在bc,溶液的pH变化不明显,是由于加入的醋酸铵溶液导致溶液体积增大,故溶液中的c(H+)减小,则pH变大,但变大的很缓慢,即ac段溶液的pH增大不只是醋酸的电离被抑制的原因,故D错误.
故选B.
点评 本题考查了弱酸和对应的盐混合后溶液pH的变化,应注意的是当在醋酸溶液中加入醋酸铵溶液后,溶液pH增大的原因不只是电离平衡的左移.

 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案| A. | 5.6g | B. | 16.8g | C. | 11.2g | D. | 33.6g |
| A. | Cl2 和 NaClO | B. | Na2O2 和 H2O2 | C. | NaOH | D. | SO2和活性炭 |
| A. | 溶液中导电粒子的数目增加,导电性增强 | |
| B. | 醋酸的电离程度增大,c(H+)亦增大 | |
| C. | 再加入10 mL pH=11 NaOH溶液,混合液pH=7 | |
| D. | 溶液中$\frac{{c[CH}_{3}{COO}^{-}]}{{c[CH}_{3}COOH]{c[OH}^{-}]}$不变 |
| 加入的物质 | 结论 | |
| A. | 100 mL 0.1 mol/L盐酸 | 溶液中2c=c(Cl-) |
| B. | 0.01 mol Na2O2固体 | 反应完全后,溶液pH增大,c(Na+)=2c(Cl-) |
| C. | 100 mL H2O | 由水电离出的c(H+)•c(OH-)不变 |
| D. | 100 mL 0.1 mol/L NH3•H2O | 溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$减小 |
| A. | A | B. | B | C. | C | D. | D |
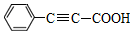 )广泛用于医药、香料等化工产品中.下列关于苯丙炔酸的说法正确的是( )
)广泛用于医药、香料等化工产品中.下列关于苯丙炔酸的说法正确的是( )| A. | 分子式为C9H7O2 | |
| B. | 与丙炔酸(CH≡C-COOH)互为同系物 | |
| C. | 是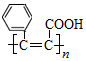 高分子化合物的单体 高分子化合物的单体 | |
| D. | 1 mol苯丙炔酸最多可与4mol氢气发生反应 |
 纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗.其制备过程如图所示、下列叙述不合理的是( )
纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗.其制备过程如图所示、下列叙述不合理的是( )| A. | 在反应②中, 的作用可能是促进氯化铁水解 的作用可能是促进氯化铁水解 | |
| B. | 反应③的化学方程式是:6FeOOH+CO═2Fe3O4+3H2O+CO2 | |
| C. | 直接加热FeCl3溶液也可以得到四氧化三铁 | |
| D. | 纳米四氧化三铁形成的分散剂,有可能产生丁达尔现象 |
 25℃时,向10mL 0.1mol•L-1 NH4HSO4溶液中逐滴滴入0.1mol•L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示:
25℃时,向10mL 0.1mol•L-1 NH4HSO4溶液中逐滴滴入0.1mol•L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示: