题目内容
17.已知某盐酸、氯化铜、氯化铁的混合溶液100mL,已知溶液中各阳离子物质的量浓度相等,氯离子总物质的量浓度为6mol•L-1,此溶液中最多可以溶解铁粉的质量为( )| A. | 5.6g | B. | 16.8g | C. | 11.2g | D. | 33.6g |
分析 溶液中各阳离子物质的量浓度相等,设均为x,氯离子总物质的量浓度为6mol•L-1,则x+2x+3x=6mol/L,解得x=1mol/L,结合Fe~2HCl、Fe~CuCl2、Fe~2FeCl3计算.
解答 解:溶液中各阳离子物质的量浓度相等,设均为x,氯离子总物质的量浓度为6mol•L-1,则x+2x+3x=6mol/L,解得x=1mol/L,混合溶液100mL,
则盐酸、氯化铜、氯化铁的物质的量均为0.1mol,
由Fe~2HCl、Fe~CuCl2、Fe~2FeCl3可知,
此溶液中最多可以溶解铁粉的质量为(0.05mol+0.1mol+0.05mol)×56g/mol=11.2g,
故选C.
点评 本题考查混合物的计算,为高频考点,把握发生的反应及物质的量关系为解答本题的关键,侧重分析与计算能力的考查,注意离子浓度与物质的量计算,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列各物质在反应中做为反应物时仅能体现还原性的是( )
| A. | 金属钠 | B. | 稀盐酸 | C. | 硫酸铜 | D. | 氯酸钾 |
8.溶液一定呈酸性的是( )
①pH<7
②c(H+)>c(OH-)的溶液
③c(H+)=10-6 mol•L-1的溶液
④0.1mol•L-1NH4Cl溶液
⑤使甲基橙显黄色的溶液.
①pH<7
②c(H+)>c(OH-)的溶液
③c(H+)=10-6 mol•L-1的溶液
④0.1mol•L-1NH4Cl溶液
⑤使甲基橙显黄色的溶液.
| A. | ②④ | B. | ①②③④ | C. | ②③④⑤ | D. | ①②③⑤ |
5.利用下列实验装置进行实验,不能达到实验目的是( )
| A. |  用四氯化碳提取溴水中的溴单质 | B. |  用自来水制取蒸馏水 | ||
| C. |  碘水中提取碘 | D. |  检验溶液中的K+ |
2.将三份1mol X气体和3mol Y气体分别充入体积为2L的A,B,C三个容器中,发生反应X(g)+3Y(g)?2Z(g).2min后反应达到平衡,测得A中剩余0.4mol X,B中Y的平衡浓度为0.5mol/L,C中用Z表示的反应速率为:v(Z)=0.3mol/(L•min),则这段时间内三个容器中反应速率的大小关系为( )
| A. | B>A>C | B. | A>B=C | C. | B>A=C | D. | B>C>A |
9.下列解释事实的离子方程式正确的是( )
| A. | 铁和稀硝酸反应制得浅绿色溶液:Fe+4H ++NO 3-═Fe 3++NO↑+2H 2O | |
| B. | 向Ca(ClO) 2溶液中通入过量CO 2制取次氯酸:2ClO-+H 2O+CO 2═2HClO+CO 32- | |
| C. | 向酸性KMnO 4溶液中通入SO 2:2MnO 4-+5SO 2+4OH -═2Mn 2++5SO 42-+2H 2O | |
| D. | 硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓ |
6.下列各组中两溶液间的反应,不能用同一离子方程式来表示的是( )
| A. | Na2CO3+HCl; K2CO3+HNO3 | B. | Fe+HCl;Fe+H2SO4 | ||
| C. | BaCl2+Na2SO4;Ba(OH)2+H2SO4 | D. | NaOH+H2O;Ba(OH)2+HCl |
7.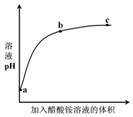 室温下,向0.01mol•L-1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵
室温下,向0.01mol•L-1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵
溶液体积变化的曲线示意图如图所示.下列分析正确的是( )
 室温下,向0.01mol•L-1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵
室温下,向0.01mol•L-1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵溶液体积变化的曲线示意图如图所示.下列分析正确的是( )
| A. | a点,pH=2 | |
| B. | b点,c(CH3COO-)>c(NH4+) | |
| C. | c点,pH可能大于7 | |
| D. | ac段,溶液pH增大是CH3COOH?H++CH3COO-逆向移动的结果 |