题目内容
15.室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )| A. | 溶液中导电粒子的数目增加,导电性增强 | |
| B. | 醋酸的电离程度增大,c(H+)亦增大 | |
| C. | 再加入10 mL pH=11 NaOH溶液,混合液pH=7 | |
| D. | 溶液中$\frac{{c[CH}_{3}{COO}^{-}]}{{c[CH}_{3}COOH]{c[OH}^{-}]}$不变 |
分析 A.加水稀释促进醋酸电离,但氢离子和醋酸根离子浓度减小;
B.加水稀释促进醋酸电离,但氢离子浓度减小;
C.pH=3的醋酸浓度大于0.001mol/L,pH=11 NaOH溶液浓度为0.001mol/L;
D.$\frac{{c[CH}_{3}{COO}^{-}]}{{c[CH}_{3}COOH]{c[OH}^{-}]}$为醋酸根离子的水解平衡常数,温度不变,水解平衡常数不变.
解答 解:A.加水稀释促进醋酸电离,但氢离子和醋酸根离子浓度减小,溶液导电能力与离子浓度成正比,所以溶液导电性减弱,故A错误;
B.加水稀释促进醋酸电离,溶液中氢离子个数增大程度小于溶液体积增大程度,所以氢离子浓度减小,故B错误;
C.pH=3的醋酸浓度大于0.001mol/L,pH=11 NaOH溶液浓度为0.001mol/L,两种溶液等体积混合,醋酸有剩余,溶液呈酸性,故C错误;
D.溶液中$\frac{{c[CH}_{3}{COO}^{-}]}{{c[CH}_{3}COOH]{c[OH}^{-}]}$为醋酸根离子的水解平衡常数,由于温度不变,则$\frac{{c[CH}_{3}{COO}^{-}]}{{c[CH}_{3}COOH]{c[OH}^{-}]}$的值不变,故D正确;
故选D.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度中等,明确弱电解质电离特点是解本题关键,状态加水稀释促进醋酸的电离,但氢离子浓度降低,为易错点,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
5.利用下列实验装置进行实验,不能达到实验目的是( )
| A. |  用四氯化碳提取溴水中的溴单质 | B. |  用自来水制取蒸馏水 | ||
| C. |  碘水中提取碘 | D. |  检验溶液中的K+ |
6.下列各组中两溶液间的反应,不能用同一离子方程式来表示的是( )
| A. | Na2CO3+HCl; K2CO3+HNO3 | B. | Fe+HCl;Fe+H2SO4 | ||
| C. | BaCl2+Na2SO4;Ba(OH)2+H2SO4 | D. | NaOH+H2O;Ba(OH)2+HCl |
3.下列物质的颜色按“红、橙、黄、绿、蓝、紫”顺序排列的是( )
①CuSO4•5H2O ②S ③溴水 ④FeCl2溶液⑤KMnO4溶液 ⑥硫氰化铁溶液.
①CuSO4•5H2O ②S ③溴水 ④FeCl2溶液⑤KMnO4溶液 ⑥硫氰化铁溶液.
| A. | ⑥③①②④⑤ | B. | ⑤④③①②⑥ | C. | ⑥③②④①⑤ | D. | ②③①④⑤⑥ |
7.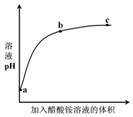 室温下,向0.01mol•L-1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵
室温下,向0.01mol•L-1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵
溶液体积变化的曲线示意图如图所示.下列分析正确的是( )
 室温下,向0.01mol•L-1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵
室温下,向0.01mol•L-1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵溶液体积变化的曲线示意图如图所示.下列分析正确的是( )
| A. | a点,pH=2 | |
| B. | b点,c(CH3COO-)>c(NH4+) | |
| C. | c点,pH可能大于7 | |
| D. | ac段,溶液pH增大是CH3COOH?H++CH3COO-逆向移动的结果 |
4.下列有关物质用途的说法,正确的是( )
| A. | 四氧化三铁俗称铁红,可用于作油漆、红色涂料 | |
| B. | 石英可用于制电脑芯片 | |
| C. | 纯碱可用于治疗胃酸过多 | |
| D. | 过氧化钠可用作于潜艇的供氧剂 |
 将气体a通入溶液b中,始终无明显变化的是( )
将气体a通入溶液b中,始终无明显变化的是( )