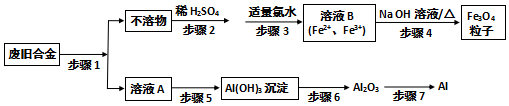
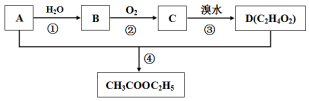
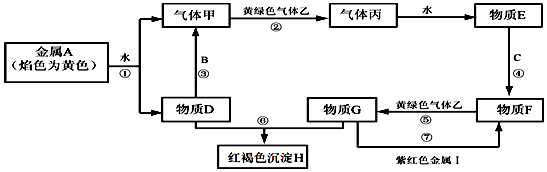
题目内容
16.运用有关原理,解决下列问题:(均在常温下进行)(1)pH=1的盐酸与pH=12的Ba(OH)2溶液混合后,测得溶液pH=7,则盐酸与Ba(OH)2溶液的体积比为1;10.
(2)测得0.01mol•L-1某一元酸(HA)pH不等于2,0.01mol•L-1某一元碱(BOH)的pH为12,将这两种溶液等体积混合,混合溶液中各离子物质的量浓度由大到小的顺序是
c(B+)>c(A-)>c(OH-)>c(H+)(用“>”表示),将混合前的两种溶液相比较,HA中水的电离程度较大(填“HA”或“BOH”).
(3)某NH4Cl溶液的pH为4,则由水电离出的c(OH-)=10-4mol/Lmol•L-1,用离子方程式表示该溶液pH<7的原因NH4++H2O?NH3•H2O+H+.
(4)将1mol NH4Cl粉末完全溶解在50mL稀氨水中,溶液的pH恰好等于7,则稀氨水的浓度为0.1mol•L-1(NH3•H2O的电离平衡常数Kb为2×10-5,溶液体积的变化忽略不计).
(5)纯碱是一种重要的化工原料,为探究该溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案向纯碱溶液中滴入酚酞溶液,呈红色,再滴入过量的氯化钙溶液,产生白色沉淀,且红色褪去.
分析 (1)pH=1的盐酸与pH=12的Ba(OH)2溶液混合后,测得溶液pH=7,则说明n(H+)=n(OH-);
(2)测得0.01mol•L-1某一元酸(HA)pH不等于2,则HA为弱酸;0.01mol•L-1某一元碱(BOH)的pH为12,则BOH为强碱;将这两种溶液等体积混合,则两者恰好完全反应生成强碱弱酸盐BA,溶液显碱性,据此分析溶液中的离子浓度大小关系;酸性或碱性越强,则对水的电离的抑制越明显,溶液中水的电离程度越小;
(3)氯化铵为强酸弱碱盐,水解显酸性,溶液中的氢离子全部由水电离出,而水电离出的c(OH-)=c(H+),据此分析;
(4)将1mol NH4Cl粉末完全溶解在50mL稀氨水中,则c(NH4Cl)=$\frac{1mol}{0.05L}$=20mol/L,设氨水的浓度为xmol/L,由于NH4Cl的水解和NH3•H2O的电离相互抑制,故溶液中c(NH4+)=20mol/L,c(NH3•H2O)=xmol/L,而溶液的pH恰好等于7,结合NH3•H2O的电离平衡常数Kb为2×10-5计算.
(5)纯碱中的CO32-水解显碱性,故滴入酚酞溶液变红,若加入试剂将CO32-沉淀,通过溶液红色变浅即可证明溶液的碱性是CO32-水解引起的;
解答 解:(1)pH=1的盐酸与pH=12的Ba(OH)2溶液混合后,测得溶液pH=7,则说明n(H+)=n(OH-),设盐酸的体积为xL,氢氧化钡溶液的体积为yL,则有:
0.1mol/L×xL=0.01mol/L×yL,则解得$\frac{x}{y}$=$\frac{1}{10}$,故答案为:1:10;
(2)测得0.01mol•L-1某一元酸(HA)pH不等于2,则HA为弱酸;0.01mol•L-1某一元碱(BOH)的pH为12,则BOH为强碱;将这两种溶液等体积混合,则两者恰好完全反应生成强碱弱酸盐BA,溶液显碱性,即c(H+)<c(OH-),据电荷守恒可知c(B+)>c(A-),即有离子浓度关系为:c(B+)>c(A-)>c(OH-)>c(H+);此分析溶液中的离子浓度大小关系;酸性或碱性越强,则对水的电离的抑制越明显,溶液中水的电离程度越小,而HA为弱酸,溶液中的c(H+)<0.01mol/L,0.01mol•L-1某一元碱(BOH)的pH为12,溶液中的c(OH-)=0.01mol/L,故两溶液中的水的电离程度前者大,即HA溶液中的水的电离程度大.故答案为:c(B+)>c(A-)>c(OH-)>c(H+);HA;
(3)NH4Cl溶液的pH为4,即c(H+)=10-4mol/L,故c(OH-)=10-10mol/L,而氯化铵溶液中的氢离子全部由水电离出,即此溶液中水电离出的c(H+)=10-4mol/L,而水电离出的c(OH-)=c(H+),即水电离出的c(OH-)=10-4mol/L;氯化铵溶液显酸性的原因是铵根离子发生水解:NH4++H2O?NH3•H2O+H+.
故答案为:10-4mol/L;NH4++H2O?NH3•H2O+H+;
(4)将1mol NH4Cl粉末完全溶解在50mL稀氨水中,则c(NH4Cl)=$\frac{1mol}{0.05L}$=20mol/L,设氨水的浓度为xmol/L,由于NH4Cl的水解程度和NH3•H2O的电离程度本来不大,且相互抑制,故溶液中c(NH4+)=20mol/L,c(NH3•H2O)=xmol/L,而溶液的pH恰好等于7,即c(OH-)=10-7mol/L,则NH3•H2O的电离平衡常数Kb=2×10-5=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{20mol/L×1{0}^{-7}mol/L}{xmol/L}$,解得x=0.1mol/L.
故答案为:0.1;
(5)向纯碱溶液中滴入酚酞溶液,呈红色,再滴入过量的氯化钙溶液,产生白色沉淀,且红色褪去,则说明溶液的碱性是CO32-水解引起的.故答案为:向纯碱溶液中滴入酚酞溶液,呈红色,再滴入过量的氯化钙溶液,产生白色沉淀,且红色褪去;
点评 本题考查了酸碱混合后溶液pH的有关计算和离子浓度大小比较,以及混合溶液中的电离平衡常数的有关计算,综合性较强,注意计算方法的掌握.

 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案| A. | Na2CO3+HCl; K2CO3+HNO3 | B. | Fe+HCl;Fe+H2SO4 | ||
| C. | BaCl2+Na2SO4;Ba(OH)2+H2SO4 | D. | NaOH+H2O;Ba(OH)2+HCl |
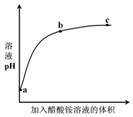 室温下,向0.01mol•L-1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵
室温下,向0.01mol•L-1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵溶液体积变化的曲线示意图如图所示.下列分析正确的是( )
| A. | a点,pH=2 | |
| B. | b点,c(CH3COO-)>c(NH4+) | |
| C. | c点,pH可能大于7 | |
| D. | ac段,溶液pH增大是CH3COOH?H++CH3COO-逆向移动的结果 |
| A. | 四氧化三铁俗称铁红,可用于作油漆、红色涂料 | |
| B. | 石英可用于制电脑芯片 | |
| C. | 纯碱可用于治疗胃酸过多 | |
| D. | 过氧化钠可用作于潜艇的供氧剂 |
| A. | 第二周期ⅡA族 | B. | 第二周期ⅢA族 | C. | 第二周期ⅠA族 | D. | 第二周期ⅣA族 |
| A. | 不能用磁铁将Fe与Fe3O4分离 | |
| B. | 将生成的气体在空气中冷却可获得钠 | |
| C. | 该反应条件下铁的氧化性比钠强 | |
| D. | 该反应中每生成2 mol H2,转移的电子数约为4×6.02×1023 |