题目内容
12.室温下,向100mL 0.1mol/L NH4Cl溶液中加入下列物质.有关结论正确的是( )| 加入的物质 | 结论 | |
| A. | 100 mL 0.1 mol/L盐酸 | 溶液中2c=c(Cl-) |
| B. | 0.01 mol Na2O2固体 | 反应完全后,溶液pH增大,c(Na+)=2c(Cl-) |
| C. | 100 mL H2O | 由水电离出的c(H+)•c(OH-)不变 |
| D. | 100 mL 0.1 mol/L NH3•H2O | 溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$减小 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.铵根离子部分水解,导致铵根离子浓度减小;
B.钠离子和氯离子的物质的量不变,根据质量守恒判断;
C.加入水后铵根离子的水解程度增大,则水电离出的c(H+)•c(OH-)增大;
D.加入一水合氨后溶液碱性最强,则氢氧根离子与氢离子的比值增大.
解答 解:A.100 mL 0.1mol/L盐酸,由于铵根离子部分水解,则2c(NH4+)<c(Cl-),故A错误;
B.钠离子和氯离子不发生水解,0.01 mol Na2O2固体反应后生成0.02mol钠离子,原溶液中含有氯离子的物质的量为:0.1mol/L×0.1L=0.01mol,则c(Na+)=2c(Cl-);且反应后氢氧化钠过量,溶液呈碱性,溶液的pH增大,故B正确;
C.加入100mLH2O后,溶液浓度减小,铵根离子的水解程度增大,则水的电离程度最大,故水电离出的c(H+)•c(OH-)的乘积会增大,故C错误;
D.加入100mL0.1 mol/LNH3•H2O,溶液碱性最强,则氢氧根离子浓度增大、氢离子浓度减小,溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$增大,故D错误;
故选B.
点评 本题考查了化学实验方案的评价,题目难度中等,明确盐的水解原理及其影响为解答关键,C为易错点,注意正确判断水的电离程度的变化情况,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
2.将三份1mol X气体和3mol Y气体分别充入体积为2L的A,B,C三个容器中,发生反应X(g)+3Y(g)?2Z(g).2min后反应达到平衡,测得A中剩余0.4mol X,B中Y的平衡浓度为0.5mol/L,C中用Z表示的反应速率为:v(Z)=0.3mol/(L•min),则这段时间内三个容器中反应速率的大小关系为( )
| A. | B>A>C | B. | A>B=C | C. | B>A=C | D. | B>C>A |
3.下列物质的颜色按“红、橙、黄、绿、蓝、紫”顺序排列的是( )
①CuSO4•5H2O ②S ③溴水 ④FeCl2溶液⑤KMnO4溶液 ⑥硫氰化铁溶液.
①CuSO4•5H2O ②S ③溴水 ④FeCl2溶液⑤KMnO4溶液 ⑥硫氰化铁溶液.
| A. | ⑥③①②④⑤ | B. | ⑤④③①②⑥ | C. | ⑥③②④①⑤ | D. | ②③①④⑤⑥ |
7.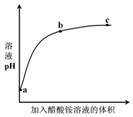 室温下,向0.01mol•L-1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵
室温下,向0.01mol•L-1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵
溶液体积变化的曲线示意图如图所示.下列分析正确的是( )
 室温下,向0.01mol•L-1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵
室温下,向0.01mol•L-1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵溶液体积变化的曲线示意图如图所示.下列分析正确的是( )
| A. | a点,pH=2 | |
| B. | b点,c(CH3COO-)>c(NH4+) | |
| C. | c点,pH可能大于7 | |
| D. | ac段,溶液pH增大是CH3COOH?H++CH3COO-逆向移动的结果 |
17.科学的假设是实验探究的先导与价值所在.下列在假设引导下的探究肯定没有意义的是( )
| A. | 探究Fe与Cl2反应可能生成FeCl2 | |
| B. | 探究Na与H2O反应可能有O2生成 | |
| C. | 探究Na2O2与SO2反应可能有Na2SO4生成 | |
| D. | 探究Mg与HNO3溶液反应产生的气体中可能含有H2 |
4.下列有关物质用途的说法,正确的是( )
| A. | 四氧化三铁俗称铁红,可用于作油漆、红色涂料 | |
| B. | 石英可用于制电脑芯片 | |
| C. | 纯碱可用于治疗胃酸过多 | |
| D. | 过氧化钠可用作于潜艇的供氧剂 |
1.某原子的一种激发态为1s22s12p1,则该元素在周期表中的位置为( )
| A. | 第二周期ⅡA族 | B. | 第二周期ⅢA族 | C. | 第二周期ⅠA族 | D. | 第二周期ⅣA族 |
2.下列工业制法和生产中,说法正确的是( )
| A. | 金属钠可以从四氯化钛溶液中置换出金属钛 | |
| B. | 工业制备和提纯硅的三步化学反应都是氧化还原反应 | |
| C. | 镁的提取中将氯化镁溶液蒸发结晶可直接获得无水氯化镁,电解熔融无水氯化镁得到金属镁 | |
| D. | 硫酸的工业制法中,依次使用的三种设备是沸腾炉,接触室,吸收塔 |
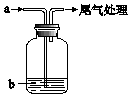 将气体a通入溶液b中,始终无明显变化的是( )
将气体a通入溶液b中,始终无明显变化的是( )