题目内容
17.以甲烷为燃料的熔融碳酸盐电池的工作原理如图所示.下列说法正确的是( )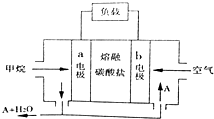
| A. | 正极的电极反应为:O2+2H2O+4e-=4OH- | |
| B. | 电池工作时,CO32-移向b电极 | |
| C. | 若实验过程中转移4mol电子,则该电池消耗11.2L CH4 | |
| D. | 为使电池稳定运行,电池的电解质组成应保持恒定.该电池工作时,应有物质A循环利用,A为CO2 |
分析 该燃料电池中负极上通入燃料甲烷,则a是负极,电解质为熔融碳酸盐,则负极反应式为CH4+4CO32--8e-=2H2O+5CO2,根据图知,A为CO2,正极上通入空气,则b为正极,正极反应式为O2+2CO2+4e-=2CO32-,放电时电解质中阴离子向负极移动、阳离子向正极移动,根据甲烷和转移电子之间的关系式计算.
解答 解:A.正极上通入空气,结合电解质知,正极反应式为O2+2CO2+4e-=2CO32-,故A错误;
B.燃料电池中通入燃料的电极是负极、通入氧化剂的电极是正极,则a是负极、b是正极,电解质中CO32-移向负极a,故B错误;
C.若实验过程中转移4mol电子,则该电池消耗标况下甲烷体积=$\frac{4mol}{8}×22.4L/mol$=11.2L,
压强和温度未知导致无法计算甲烷体积,故C错误;
D.负极反应式为CH4+4CO32--8e-=2H2O+5CO2,根据图知,A为CO2,且二氧化碳有使电池稳定运行,电池的电解质组成应保持恒定作用,故D正确;
故选D.
点评 本题考查化学电源新型电池,为高频考点,侧重考查学生分析判断及计算能力,明确正负极判断方法及各个电极上发生的反应是解本题关键,易错选项是C,注意气体摩尔体积适用范围及其适用条件.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.下列说法正确的是( )
| A. | 食盐水、稀豆浆、蔗糖水都能产生丁达尔效应 | |
| B. | “玉兔”月球车太阳能电池帆板的主要材料是二氧化硅 | |
| C. | 新能源汽车的推广与使用有助于减少光化学烟雾的产生 | |
| D. | 黑火药含有硫磺、硝酸钾和木炭,其中硝酸钾是电解质,硫磺和木炭是非电解质 |
5.可以用分液漏斗分离的一组液体混合物是( )
| A. | 溴和四氯化碳 | B. | 苯和溴苯 | C. | 汽油和苯 | D. | 溴苯和水 |
2.下列对某未知溶液中离子的检验方法及其结论一定正确的是( )
| A. | 取溶液进行焰色反应显黄色,一定含有Na+ | |
| B. | 滴加BaCl2溶液,产生白色沉淀,证明有SO42- | |
| C. | 滴加KSCN溶液,变为血红色,溶液中含Fe2+ | |
| D. | 加入稀盐酸产生无色气体,一定含有CO32- |
9.元素X的原子有3个电子层,最外层有4个电子.这种元素位于周期表的( )
| A. | 第4周期ⅢA族 | B. | 第4周期ⅦA族 | C. | 第3周期Ⅳ族 | D. | 第3周期ⅣA族 |
6.下列物质中,与苯酚互为同系物的是( )
| A. |  | B. |  | C. |  | D. | C7H8O |