题目内容
5.可以用分液漏斗分离的一组液体混合物是( )| A. | 溴和四氯化碳 | B. | 苯和溴苯 | C. | 汽油和苯 | D. | 溴苯和水 |
分析 用分液漏斗分离的一组液体混合物,二者不互溶,出现分层,以此来解答.
解答 解:A、B、C中的物质不出现分层,不能利用分液分离,只有D中溴苯不溶于水,分层后水在上层,可用分液漏斗分离,
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质为解答的关键,注意溶解性的分析及分液需要的仪器为分液漏斗,题目难度不大.

练习册系列答案
相关题目
15.将一定质量的钠铝合金置于水中,合金全部溶解.得到20mLNaOH和NaAlO2的混合溶液,然后用lmol/L的盐酸与之反应.至沉淀量最大时消耗盐酸40mL,则原合金中钠的质量为( )
| A. | 0.92g | B. | 0.69g | C. | 0.46g | D. | 0.23g |
16.把Cu粉放入稀硫酸,加热后并无明显现象,当加入一种盐的晶体后,可看到溶液呈蓝色,同时有气体逸出,此盐晶体是( )
| A. | FeCl3 | B. | Na2SO4 | C. | Na2CO3 | D. | NaNO3 |
13.锂电池是新一代的高能电池,它以质轻、能高而受到普遍重视.目前已经研制成功了多种锂电池.某种锂电池的总反应可表示为:Li+MnO2═LiMnO2,若该电池提供5C电荷量(其他损耗忽略不计),则消耗的正极材料的质量约为(式量Li:7,MnO2:87,电子电荷量取1.60×10-19 C)( )
| A. | 3.5×10-3 g | B. | 7×10-4 g | C. | 4.52×10-3 g | D. | 4.52×10-2 g |
17.以甲烷为燃料的熔融碳酸盐电池的工作原理如图所示.下列说法正确的是( )
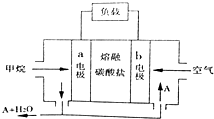

| A. | 正极的电极反应为:O2+2H2O+4e-=4OH- | |
| B. | 电池工作时,CO32-移向b电极 | |
| C. | 若实验过程中转移4mol电子,则该电池消耗11.2L CH4 | |
| D. | 为使电池稳定运行,电池的电解质组成应保持恒定.该电池工作时,应有物质A循环利用,A为CO2 |
14.已知在酸性条件下有以下反应关系:
(1)KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2.
(2)Br2能将I-氧化为I2.
(3)KIO3能将I-氧化为I2,也能将Br-氧化为Br2,其本身被还原为I2.
①上述物质中氧化剂氧化能力由强到弱的顺序是KBrO3>KIO3>Br2.
②现向含有1molKI的硫酸溶液中加入含amolKBrO3的溶液,a的取值范围不同,所得产物也不同.试将讨论的结果填入下表.
③若产物中碘单质和碘酸钾的物质的量相等,a的值为$\frac{8}{15}$.
④若a的值为1时,其产物及其物质的量分别为I2:0.1mol、KIO3:0.8mol、Br2:0.5mol.
(1)KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2.
(2)Br2能将I-氧化为I2.
(3)KIO3能将I-氧化为I2,也能将Br-氧化为Br2,其本身被还原为I2.
①上述物质中氧化剂氧化能力由强到弱的顺序是KBrO3>KIO3>Br2.
②现向含有1molKI的硫酸溶液中加入含amolKBrO3的溶液,a的取值范围不同,所得产物也不同.试将讨论的结果填入下表.
| 编号 | a的取值范围 | 产物的化学式或(离子符号) |
| A | a≤$\frac{1}{6}$ | I2,Br- |
| B | $\frac{1}{6}$<a<$\frac{1}{5}$ | I2、Br-、Br2 |
| C | a=$\frac{1}{5}$ | I2、Br2 |
| D | $\frac{1}{5}$<a<$\frac{6}{5}$ | I2,IO3-,Br2 |
| E | a≥$\frac{6}{5}$ | IO3-、Br2 |
④若a的值为1时,其产物及其物质的量分别为I2:0.1mol、KIO3:0.8mol、Br2:0.5mol.
15.某温度下,2L密闭容器中加入4mol A和2mol B发生反应:3A(g)+2B(g)═4C(s)+2D(g).平衡时测得n(C)=1.6mol.下列说法正确的是( )
| A. | 化学平衡常数K=$\frac{{c}^{4}(C)•{c}^{2}(D)}{{c}^{3}(A)•{c}^{2}(B)}$ | |
| B. | 增大压强,平衡右移,K平衡增大 | |
| C. | B的平衡转化率是40% | |
| D. | 其他条件不变,向平衡体系中加入少量C,v正、v逆均增大 |
 ,
,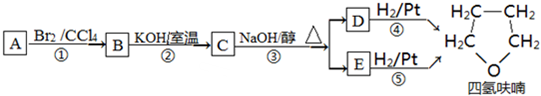
 ,D
,D ,E
,E .
.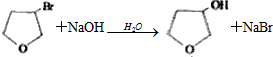 .
.