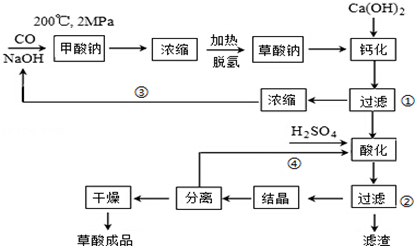
题目内容
13.甲醇是一种重要的化工原料和新型燃料.(1)CO2加氢制取低碳醇的反应如下:
反应I:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.0kJ/mol
反应II:2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(g)△H=-173.6kJ/mol
则2CH3OH(g)═CH3CH2OH(g)+H2O(g)△H=-75.60kJ•mol-1;
(2)图一为甲醇燃料电池原理图,电极B为正极(填“正”或“负”),请写出该电池的总的化学反应方程式2CH3OH+3O2+4KOH=2K2CO3+6H2O;

(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用图二装置模拟上述过程:
①写出阳极电极反应式Co2+-e-=Co3+;②写出除去甲醇的离子反应方程式6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
分析 (1)据盖斯定律Ⅱ-I×2得:2CH3OH(g)=CH3CH2OH(g)+H2O(g)的反应热;
(2)通入甲醇的一级为负极,发生氧化反应,通入氧气的一级为正极,发生还原反应,甲醇在碱性条件下被氧化生成碳酸根离子和水;
(3)阳极发生氧化反应Co2+氧化成Co3+,以Co3+做氧化剂把水中的甲醇氧化成CO2,同时生成Co2+.
解答 解:(1)已知:反应I:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0 kJ•mol-1
反应II:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=-173.6kJ•mol-1
根据盖斯定律Ⅱ-I×2得:2CH3OH(g)=CH3CH2OH(g)+H2O(g);△H=-75.6 kJ•mol-1,
故答案为:-75.60 kJ•mol-1;
(2)通入氧气的一级为正极,发生还原反应,甲醇在碱性条件下与氧气反应生成碳酸钾和水,总方程式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,
故答案为:正;2CH3OH+3O2+4KOH=2K2CO3+6H2O;
(3)阳极发生氧化反应Co2+氧化成Co3+,电极方程式为Co2+-e-=Co3+,以Co3+做氧化剂把水中的甲醇氧化成CO2,同时生成Co2+,离子方程式为6Co3++CH3OH+H2O=CO2↑+6 Co2++6H+,
故答案为:Co2+-e-=Co3+;6Co3++CH3OH+H2O=CO2↑+6 Co2++6H+.
点评 本题综合性较大,涉及热化学方程式以及电化学知识等,为高考常见题型,侧重于学生的分析、计算能力的考查,难度中等,注意电极方程式的书写以及盖斯定律的运用.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案
相关题目
1.已知同一碳原子连有两个羟基不稳定: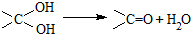 .有机物
.有机物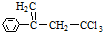 是选择性内吸传导性除草剂,俗称稗草烯,主要用于水稻田防除稗草.下列有关该有机物的说法错误的是( )
是选择性内吸传导性除草剂,俗称稗草烯,主要用于水稻田防除稗草.下列有关该有机物的说法错误的是( )
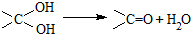 .有机物
.有机物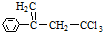 是选择性内吸传导性除草剂,俗称稗草烯,主要用于水稻田防除稗草.下列有关该有机物的说法错误的是( )
是选择性内吸传导性除草剂,俗称稗草烯,主要用于水稻田防除稗草.下列有关该有机物的说法错误的是( )| A. | 能使酸性高锰酸钾溶液褪色 | |
| B. | 可用 与Cl2在光照条件下通过取代反应获得较纯的该物质 与Cl2在光照条件下通过取代反应获得较纯的该物质 | |
| C. | 在碱性条件下充分水解,可生成羧酸钠 | |
| D. | 在一定条件下可发生聚合反应 |
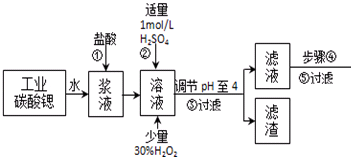
1.高纯六水氯化锶晶体(SrCl2•6H2O)具有很高的经济价值,工业上用w kg难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),共制备高纯六水氯化锶晶体(a kg)的过程为:
已知:Ⅰ.SrCl2•6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
(1)操作①加快反应速率的措施有加热、充分搅拌、适当增加盐酸浓度等 (写一种).操作①中盐酸能否改用硫酸,其理由是:不能,否则会大量生成硫酸锶的沉淀,减少产物生物
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为B.
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4 (填化学式).
(5)工业上完成操作③常用的设备有:B
A分馏塔 B 离心机 C 热交换器 D 反应釜
(6)工业上用热风吹干六水氯化锶,适宜的温度是B
A.40~50℃B.50~60℃C.60~70℃D.80℃以上.
(7)已知工业流程中锶的利用率为90%根据以上数据计算工业碳酸锶的纯度:$\frac{1480a}{267W×9}$×100%.

已知:Ⅰ.SrCl2•6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为B.
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4 (填化学式).
(5)工业上完成操作③常用的设备有:B
A分馏塔 B 离心机 C 热交换器 D 反应釜
(6)工业上用热风吹干六水氯化锶,适宜的温度是B
A.40~50℃B.50~60℃C.60~70℃D.80℃以上.
(7)已知工业流程中锶的利用率为90%根据以上数据计算工业碳酸锶的纯度:$\frac{1480a}{267W×9}$×100%.
8.核黄素又称为维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳.核黄素分子的结构为: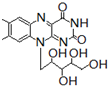
已知: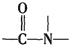 +H2O$→_{△}^{H+}$
+H2O$→_{△}^{H+}$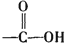 +
+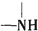 ,有关核黄素的下列说法中,正确的是( )
,有关核黄素的下列说法中,正确的是( )

已知:
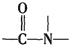 +H2O$→_{△}^{H+}$
+H2O$→_{△}^{H+}$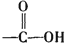 +
+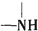 ,有关核黄素的下列说法中,正确的是( )
,有关核黄素的下列说法中,正确的是( )| A. | 该物质属于有机高分子 | B. | 不能发生酯化反应 | ||
| C. | 不能与氢气发生加成反应 | D. | 酸性条件下加热水解,有CO2生成 |
18.25℃时,下列有关溶液的说法正确的是( )
| A. | 难溶电解质Ag2SO4的饱和溶液中,若c(SO42-)=amol•L-1,则Ksp(Ag2SO4)=2a3 | |
| B. | 某氨水的pH=11,将此溶液稀释10倍后,溶液的pH<10 | |
| C. | Ka(HCN)<Ka(CH3COOH),说明相同温度下同浓度的HCN溶液的酸性比CH3COOH溶液的强 | |
| D. | pH=8的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-) |
5.化学知识在生产、生活、科技、环境等领域有着重要的应用,下列有关说法正确的是( )
| A. | 门捷列夫利用软锰矿和浓盐酸反应制得了氯气 | |
| B. | 利用火力发电厂及核电站用于冷却的循环海水来提取单质溴以减少能耗 | |
| C. | 含重金属离子的污水的排放产生“赤潮”或“水华”等水污染现象 | |
| D. | 钢化玻璃、有机玻璃、防弹玻璃均属于硅酸盐材料 |
3.NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 16g CH4所含原子数目为NA | |
| B. | 1mol•L-1 NaCl溶液含有NA个Na+ | |
| C. | 常温常压下,22.4L CO2中含有NA个CO2分子 | |
| D. | 2.4g Mg与足量盐酸反应转移的电子数为0.2NA |