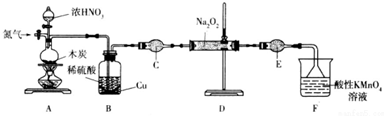
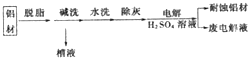
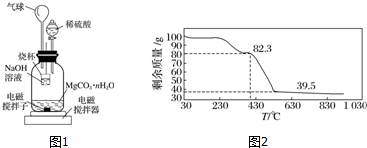
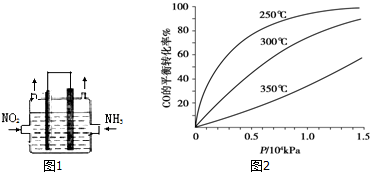
题目内容
8.核黄素又称为维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳.核黄素分子的结构为: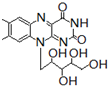
已知:
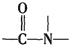 +H2O$→_{△}^{H+}$
+H2O$→_{△}^{H+}$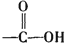 +
+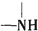 ,有关核黄素的下列说法中,正确的是( )
,有关核黄素的下列说法中,正确的是( )| A. | 该物质属于有机高分子 | B. | 不能发生酯化反应 | ||
| C. | 不能与氢气发生加成反应 | D. | 酸性条件下加热水解,有CO2生成 |
分析 有机物分子中含有C=N,可发生加成、氧化反应,含有羟基,可发生取代、氧化和消去反应,含有 根据信息可知,它在酸性条件下水解可生成
根据信息可知,它在酸性条件下水解可生成 ,即碳酸,可生成CO2,以此解答该题.
,即碳酸,可生成CO2,以此解答该题.
解答 解:A.高分子化合物的相对分子质量在10000以上,不是高分子化合物,故A错误;
B.含有羟基,可发生酯化反应,故B错误;
C.含有苯环,可与氢气发生加成反应,故C错误;
D.含有 根据信息可知,它在酸性条件下水解可生成
根据信息可知,它在酸性条件下水解可生成 ,即碳酸,可生成CO2,故D正确.
,即碳酸,可生成CO2,故D正确.
故选D.
点评 本题考查有机物的结构和性质,是高考中的常见题型和重要的考点之一,属于中等难度的试题,试题基础性强,侧重对学生能力的培养和解题方法的指导,该题的关键是准确判断出分子中含有的官能团,然后依据相应官能团的结构和性质,灵活运用即可,有利于培养学生的知识迁移能力和辑推理能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.M元素的一个原子失去两个电子并转移到Y元素的两个原子中,形成离子化合物Z,下列 说法不正确的是( )
| A. | Z的熔点较高 | B. | Z可以表示为M2Y | ||
| C. | Z可能易溶于水 | D. | M形成+2价的阳离子 |
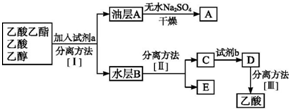 实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品.
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品.