题目内容
18.25℃时,下列有关溶液的说法正确的是( )| A. | 难溶电解质Ag2SO4的饱和溶液中,若c(SO42-)=amol•L-1,则Ksp(Ag2SO4)=2a3 | |
| B. | 某氨水的pH=11,将此溶液稀释10倍后,溶液的pH<10 | |
| C. | Ka(HCN)<Ka(CH3COOH),说明相同温度下同浓度的HCN溶液的酸性比CH3COOH溶液的强 | |
| D. | pH=8的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-) |
分析 A.c(SO42-)=amol•L-1,银离子浓度为2amol/L,结合难溶物溶度积的表达式计算;
B.氨水为弱碱,稀释后电离出的氢氧根离子的物质的量增大;
C.电离平衡常数越大,相同条件下酸性越强;
D.碳酸氢钠溶液的pH=8,溶液呈碱性,说明碳酸氢根离子的电离程度大于其电离程度.
解答 解:A.难溶电解质Ag2SO4的饱和溶液中,若c(SO42-)=amol•L-1,则银离子浓度为2amol/L,则Ksp(Ag2SO4)=a×(2a)2=4a3,故A错误;
B.某氨水的pH=11,将此溶液稀释10倍后,由于一水合氨的电离程度增大,则稀释后溶液的pH>10,故B错误;
C.Ka(HCN)<Ka(CH3COOH),说明相同温度下同浓度的HCN溶液的酸性比CH3COOH溶液的弱,故C错误;
D.pH=8的NaHCO3溶液中,HCO3-的电离程度大于其水解程度,则c(H2CO3)>c(CO32-),由于氢氧根离子来自水的电离和碳酸氢根离子的电离,则c(OH-)>c(H2CO3),溶液中离子浓度大小为:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-),故D正确;
故选D.
点评 本题考查了弱电解质的电离平衡、难溶物的溶解平衡及计算,题目难度中等,明确电离平衡及其影响为解答关键,注意掌握难溶物溶度积的概念及表达式,试题培养了学生的灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列离子方程式正确的是( )
| A. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| B. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- | |
| C. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+4H++2MnO4-═5SO42-+2Mn2++2H2O | |
| D. | 向AlCl3溶液滴入过量氨水:Al3++4OH-═AlO2-+2H2O |
10.下列各装置能够达到相应实验目的是( )
| A. |  用装置除去乙酸乙酯中混有的少量乙酸 | |
| B. |  用装置除去氯气中的少量氯化氢 | |
| C. | 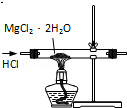 用装置制取无水MgCl2 | |
| D. |  用装置制取乙烯 |
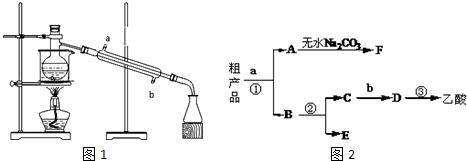
 .
. 用图中的实验装置制取乙炔.
用图中的实验装置制取乙炔. .
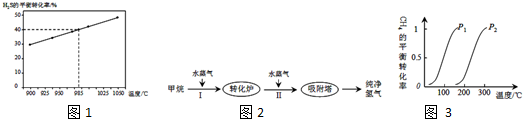
.


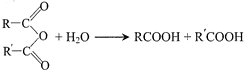
 ,G
,G
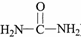 )氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式
)氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式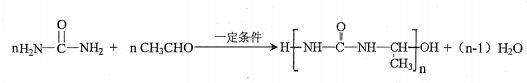
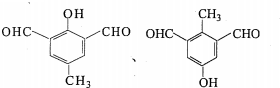 任意一种.
任意一种.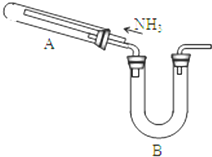 某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如图.
某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如图.