题目内容
19.化学与生活息息相关,在研究具体问题的时候会运用很多方法,其中一种就是把体积和压强的影响,转化成盒子进行研究.I在一密闭气缸内,用不漏气的可滑动的活塞隔成两室(图1),左室充有甲烷(CH4)和氧气的混合气体,右室充有氯气和氢气.已知当氧气足够多时甲烷完全燃烧,生成CO2,氧气不足时有CO生成,Cl2+H2═2HCl.在室温下,静止在气缸的“3”处(液体体积忽略不计).
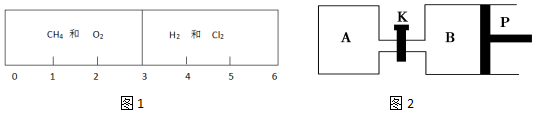
(1)若反应前左室中CH4与O2物质的量之比为1:2,现将左右两室混合气体点燃,完全反应,冷却至原室温,活塞最终静止于气缸1.5处(填具体刻度).
(2)若左室反应前充有一定量的CH4与O2的混合气体,点燃左右两室气体,使其充分反应,在左室中未检测到有毒气体,冷却至室温,活塞最终静止于气缸“2”处,求反应前CH4与O2的物质的量之比为1:3.
II(1)室温下,现有20LO2,把它通入14L CO和H2的混合气体中,完全燃烧,干燥后恢复到原来的温度.若剩余气体的体积为nL,则原混合气体中V(CO):V(H2)=$\frac{n-13}{27-n}$,n的取值范围是13<n<27.
(2)若用图2装置进行O2的燃烧反应,其中P是可自由平行滑动的活塞,关闭K,将6molH2充入容器的A室中,将2molCO与8molO2的混合气体充入容器的B室中.已知起始时容器A和B的体积均为a L.试回答:
i点燃B室中的混合气体,恢复到120℃,反应达到平衡时容器B的体积为0.9aL.
ii若打开K,点燃混合气体,使CO、H2和O2充分反应,恢复到120℃则反应完全后,容器B的体积为0.2aL(连通管中气体体积忽略不计,且不考虑温度的影响).
分析 I.(1)同温同压下,气体的体积之比等于物质的量之比,反应前气体的物质的量之比为3:3,反应后左右两室气体的物质的量之比为1:3;
(2)设的CH4的物质的量为x mol,O2的物质的量为y mol,此时右室气体的物质的量为(x+y)mol,通过计算CH4+2O2→CO2+2H2O计算剩余气体的物质的量,左右两室气体的物质的量之比为$\frac{1}{2}$;
II.(1)O2+2CO$\frac{\underline{\;点燃\;}}{\;}$2CO2、O2+2H2$\frac{\underline{\;点燃\;}}{\;}$2H2O,若剩余气体的体积为nL,则气体体积减少(20+14-n)L,根据CO和氢气体积之和及气体体积减少量列方程式组计算;采用极限法计算n的范围,如果气体完全是CO时,剩余气体体积最大,如果气体完全是氢气,剩余气体体积最小;
(2)i.B室为恒温恒压条件,气体的体积之比等于其物质的量之比,计算反应后剩余气体的体积;
ii.若打开K,反应前气体的体积为a L×$\frac{2mol+8mol+6mol}{2mol+8mol}$,通过O2+2CO$\frac{\underline{\;点燃\;}}{\;}$2CO2、O2+2H2$\frac{\underline{\;点燃\;}}{\;}$2H2O计算反应后剩余气体的总物质的量,依据恒温恒压条件,气体的体积之比等于其物质的量之比,计算出反应后气体的体积,减去a L即为反应后容器B的体积.
解答 解:I.(1)同温同压下,气体的体积之比等于物质的量之比,由图1可知反应前气体的物质的量之比为3:3,由CH4+2O2→CO2+2H2O、Cl2+H2═2HCl可知应后左右两室气体的物质的量之比为1:3,所以活塞最终静止于气缸于6×$\frac{1}{4}$=1.5处,
故答案为:1.5;
(2)设的CH4的物质的量为x mol,O2的物质的量为y mol,右室气体的总物质的量反应前后均为(x+y)mol,
CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O
开始:x mol ymol 0
变化:xmol 2xmol xmol
结束:0 (y-2x)mol xmol
所以 $\frac{(y-2)mol+xmol}{(x+y)mol}$=$\frac{1}{2}$,解得$\frac{x}{y}$=1:3,
故答案为:1:3;
II.(1)O2+2CO$\frac{\underline{\;点燃\;}}{\;}$2CO2、O2+2H2$\frac{\underline{\;点燃\;}}{\;}$2H2O,
若剩余气体的体积为nL,则气体体积减少(20+14-n)L,设CO、H2的体积分别是xL、yL,
$\left\{\begin{array}{l}{x+y=14}\\{0.5x+1.5y=20+14-n}\end{array}\right.$解得x=n-13,y=27-n,
所以V(CO):V(H2)=$\frac{x}{y}$=$\frac{n-13}{27-n}$;
如果完全是CO,则气体减少的体积为7L,剩余气体体积为(20+14-7)L=27L,
如果完全是H2,则气体减少的体积为21L,剩余气体体积为(20+14-21)L=13L,
所以n得取值范围为13<n<27,
故答案为:$\frac{n-13}{27-n}$;13<n<27;
(2)i.2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2
开始:2mol 8mol 0
变化:2mol 1mol 2mol
结束:0 7mol 2mol
反应后剩余气体总的物质的量为7mol+2mol=9mol,
iB室为恒温恒压条件,气体的体积之比等于其物质的量之比,所以反应达到平衡时容器B的体积为a L×$\frac{9mol}{2mol+8mol}$=0.9aL,
故答案为:0.9a;
ii.若打开K,反应前气体的体积为a L×$\frac{2mol+8mol+6mol}{2mol+8mol}$=1.6a L,
O2+2CO$\frac{\underline{\;点燃\;}}{\;}$2CO2、O2+2H2$\frac{\underline{\;点燃\;}}{\;}$2H2O,反应后气体的总物质的量为(2mol+8mol+6mol-3mol-1mol)=12mol,
所以反应后气体的体积为1.6a L×$\frac{12mol}{16mol}$=1.2a L,反应后容器B的体积为1.2a L-a L=0.2a L,
故答案为:0.2a.
点评 本题考查化学方程式的计算、有关范围题的计算,题目难度较大,侧重分析与计算能力的考查,明确恒温恒压条件下,气体的体积之比等于其物质的量之比是关键.

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案| A. | C5H10和C6H8 | B. | C2H6和C3H8 | C. | C3H6和C3H8O | D. | C2H6O和C2H4O2 |
| A. | 氢氧化钠溶液、盐酸都为强电解质 | |
| B. | 铁生锈、食物腐败都涉及有氧化还原反应 | |
| C. | 漂白粉、冰醋酸、氢氧化铁胶体均为混合物 | |
| D. | 二氧化氮、二氧化硅都是酸性氧化物 |
| A. | 该电池负极的电极反应为:Al-3e═Al3+ | |
| B. | 电池工作时,溶液中的铝离子向正极移动 | |
| C. | 消耗相同质量金属时,用锂做负极时,产生电子的物质的量比铝多 | |
| D. | 正极的电极材料是单质碘 |
| A. | 当混合溶液的pH>7时,其中不可能存在HAc分子 | |
| B. | 当混合溶液的pH<7时,混合液中c(Na+)>c((Ac-) | |
| C. | 判断该滴定过程的终点,最好选择甲基橙作为指示剂 | |
| D. | 达到滴定终点时,混合液中c(Na+)和c((Ac-)一定不相等 |
 名称:2,3-二甲基辛烷
名称:2,3-二甲基辛烷 名称:3,5-二甲基庚烷.
名称:3,5-二甲基庚烷. 在一定温度压强下,某反应在某体积为5L的密闭容器中进行,各物质的量的变化情况如图所示(A,B,C均为气体)
在一定温度压强下,某反应在某体积为5L的密闭容器中进行,各物质的量的变化情况如图所示(A,B,C均为气体)