��Ŀ����
11��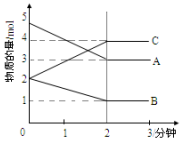 ��һ���¶�ѹǿ�£�ij��Ӧ��ij���Ϊ5L���ܱ������н��У������ʵ����ı仯�����ͼ��ʾ��A��B��C��Ϊ���壩
��һ���¶�ѹǿ�£�ij��Ӧ��ij���Ϊ5L���ܱ������н��У������ʵ����ı仯�����ͼ��ʾ��A��B��C��Ϊ���壩��1���÷�Ӧ�Ļ�ѧ����ʽΪ2A+B?2C
��2��0��2min�ڣ���B��ʾ��ƽ����Ӧ����Ϊ0.1mol/��L•min��������ͼ�����ݼ���ƽ��ʱ��ƽ�ⳣ��K=$\frac{8}{9}$���������
��3���ڸ������£�ijʱ�̲����ϵ�����ʵ���Ũ�����£�c��A��=0.6mol/L��c��B��=0.9mol/L��c��C��=0.10mol/L�����ʱ�÷�Ӧ����������У������������С��������淽����С�����ƽ��״̬���������ڸ��¶���ά��ѹǿ���䣬����3.5mol A��1.5mol B����Ӧ�ﵽƽ��ʱB��ת���ʷ�Χ50%
��4��ά��������������¶Ȳ��䣬���������������Ϊ��ʼ���ʣ��ﵽƽ���C��Ũ������0.8mol/L����C������ţ�
A��4mol A+2mol B B��6mol C C��3mol A+1mol B+4mol C D.4mol C+1mol A
��5������ϣ������A��ת���ʣ����д�ʩ���е���C
A ���� Bѹǿ��������������C �����������C Dѹǿ�������C E �Ӵ�����
���� ��1����ͼ����Կ�����A��B�����ʵ�����С����A��BΪ��Ӧ�C�����ʵ��������࣬����CΪ������������ʵ����ʵ����仯ֵ���ڻ�ѧ������֮����д��ѧ���̣�
��2����ѧ��Ӧ�����ǵ�λʱ����Ũ�ȵı仯����V=$\frac{��c}{��t}$���㷴Ӧ���ʣ�ƽ�ⳣ��K=$\frac{������ƽ��Ũ���ݴη��˻�}{��Ӧ��ƽ��Ũ���ݴη��˻�}$��
��3�������ʱ��Ũ����Qc����ƽ�ⳣ��K�Ƚ��жϷ�Ӧ���еķ����º�ѹ�£�����3.5mol A��1.5mol B��ͼ�мӷ�Ϊ��Чƽ�⣻
��4�����º����£�����2A+B?2C���ԣ�ֻҪ��ʹ�����ʵij�ʼ���ʵ����ֱ���ȣ��Ϳ��Խ�����ͬƽ�⣻
��5��A��2A+B?2C���������ȷ�Ӧ��Ҳ�����Ƿ��ȷ�Ӧ��
B��ѹǿ�������������壬�൱�ڼ�С����ϵ��ѹǿ��
C�������������C��������C��Ũ�ȣ�
D��ѹǿ�������C��������C��Ũ��
E�������Ի�ѧƽ����ƶ���Ӱ�죮
��� �⣺��1����ͼ����Կ�����A��B�����ʵ�����С����A��BΪ��Ӧ�C�����ʵ��������࣬����CΪ���������Ӧ����2minʱ����n��A��=2mol����n��B��=1mol����n��C��=2mol����ѧ��Ӧ�У������ʵ����ʵ����ı仯ֵ�뻯ѧ�����������ȣ����n��A������n��B������n��C��=2��1��2�����Է�Ӧ�Ļ�ѧ����ʽΪ��2A+B?2C��
�ʴ�Ϊ��2A+B?2C��
��2��0��2min�ڣ�B�������ʵ���1mol����B��ʾ��ƽ����Ӧ����=$\frac{\frac{1mol}{5L}}{2min}$=0.1mol/��L•min����0��2min�ڷ�Ӧ�ﵽƽ��״̬��A���ʵ���3mol��B���ʵ���Ϊ1mol��C���ʵ���4mol��ƽ�ⳣ��K=$\frac{��\frac{4}{5}��^{2}}{��\frac{3}{5}��^{2}��\frac{1}{5}}$=$\frac{8}{9}$��
�ʴ�Ϊ��$\frac{8}{9}$��
��3��Qc=$\frac{0.1{0}^{2}}{0��{6}^{2}��0.9}$=0.03��$\frac{8}{9}$�����Դ�ʱ�÷�Ӧ����������У�
ͼ�п�ʼ����5molA��2molB��2molC�൱�ڼ���7molA��3molB�����Ժ��º�ѹ�£�����3.5mol A��1.5mol B��֮�γɵ�Чƽ�⣬��Ӧ�ﵽƽ��ʱB��ת����Ϊ$\frac{2mol-1mol}{2mol}$��100%=50%��
�ʴ�Ϊ������������У�50%��
��4��ͼ�г�ʼ���ʵ����൱�ڼ���7molA��3molB��
A��4mol A+2mol B�����7molA��3molB���ȣ����ǵ�Чƽ�⣬��A����
B��6mol C �൱�ڼ���6molA��3molB����7molA��3molB���ȣ����ǵ�Чƽ�⣬��B����
C��3mol A+1mol B+4mol C�൱�ڼ������7molA��3molB��Ϊ��Чƽ�⣬�ﵽƽ���C��Ũ������0.8mol/L����C��ȷ��
D��4mol C+1mol A�൱�ڼ���5molA��2molB����7molA��3molB���ȣ����ǵ�Чƽ�⣬��D����
�ʴ�Ϊ��C��
��5��A��2A+B?2C�ķ�Ӧ��δ֪���������£���֪����ѧƽ������ƶ�����A����
B��ѹǿ�������������壬�൱�ڼ�С����ϵ��ѹǿ��ƽ�������ƶ���A��ת���ʼ�С����B����
C�������������C��������C��Ũ�ȣ���ѧƽ�������ƶ���A��ת��������C��ȷ��
D��ѹǿ�������C��������C��Ũ�ȣ���ѧƽ�������ƶ���A��ת���ʼ�С����D����
E���Ӵ�������ѧƽ�ⲻ�ƶ���A��ת���ʲ��䣬��E����
�ʴ�Ϊ��C��
���� ���⿼�����ʵ�����ʱ��ı仯���ߣ��ۺ��Խ�ǿ���ѶȽϴ����ڻ�ѧ����ʽ��ȷ������ѧ��Ӧ���ʺͻ�ѧƽ���ƶ���Ӧ�ã����е�Чƽ��Ϊ�����ѵ㣮

 ��ĩ�óɼ�ϵ�д�
��ĩ�óɼ�ϵ�д� 99��1������ĩ��ѵ��ϵ�д�
99��1������ĩ��ѵ��ϵ�д� ��ǿ��У��ĩ���100��ϵ�д�
��ǿ��У��ĩ���100��ϵ�д� �óɼ�1��1��ĩ���100��ϵ�д�
�óɼ�1��1��ĩ���100��ϵ�д� ��״Ԫ���źþ�ϵ�д�
��״Ԫ���źþ�ϵ�д�| A�� | ��Ƭ��ϡ����ķ�Ӧ | B�� | Ba��OH��2•8H2O��NH4Cl�ķ�Ӧ | ||
| C�� | ���ȵ�̿��CO2�ķ�Ӧ | D�� | ���ȵĽ�̿��ˮ�����ķ�Ӧ |
| A�� | ���³�ѹ�£�5.6g Fe������Cl2��ַ�Ӧת�Ƶ�������Ϊ0.2NA | |
| B�� | �ܱ�������2molNO��1molO2��ַ�Ӧ������������ķ�����Ϊ2NA | |
| C�� | ����������ˮ��Ӧʱ������0.1mol����ת�Ƶĵ�����Ϊ0.4NA | |
| D�� | 1 L 0��lmol•L-1��CH3COONa��Һ��CH3COO-��CH3COOH������֮��Ϊ0.1NA |
| A�� | �����¶� | B�� | ��Сѹǿ | C�� | ʹ�ô��� | D�� | ��ʱ��������� |
| ѡ�� | Ŀ�� | ���뷽�� |
| A | ��ȥͭ�������ͭ�̡�Cu2��OH��2CO3�� | ��������ݣ�����ˮ��ϴ |
| B | ��ȥ�Ҵ��е�����ˮ | ����ʯ�ң������� |
| C | ��ȥ HCl�е� C12 | ͨ������ʳ��ˮϴ���ٸ��� |
| D | ��ȥNaCl�� ���е� NH4Cl | ���� |
| A�� | A | B�� | B | C�� | C | D�� | D |
| ��Է������� | �ܶ�/g•cm-3 | �е�/�� | �ܽ��� | |
| A | 78 | 0.8786 | 80 | A��B��C���� |
| B | 74 | 0.81018 | 108 | |
| C | 130 | 0.8670 | 142 |
| A�� | ����������ķ������з��� | |
| B�� | �����ù��˵ķ������з��� | |
| C�� | �������������������������ȴˮ������Ӧ���������������෴ | |
| D�� | ��ʵ�����õ��IJ��������У��ƾ��ơ�������ƿ�������ܡ���Һ�ܡ���ƿ |
| A�� | N2O��CO2��ѧ������ȫ��ͬ | B�� | N2O�ĵ���ʽ�ɱ�ʾ�� | ||
| C�� | N2O��CO2�������Ǽ��Լ� | D�� | N2OΪ�����η��� |