题目内容
14.将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解,产生的一氧化氮和二氧化氮混合气体在标准状况下的体积为11.2L.试计算:(1)混合气体中一氧化氮和二氧化氮的体积各位多少?
(2)被还原的硝酸的物质的量为多少?
分析 (1)设NO和NO2的物质的量分别为xmol、ymol,根据二者总体积、电子转移守恒列方程,再根据V=nVm体积.
(2)根据N原子守恒计算消耗的硝酸.
解答 解:(1)32.64g铜的物质的量为$\frac{32.64g}{64g/mol}$=0.51mol,在反应中失去的电子的物质的量为2×0.51mol=1.02mol,11.2L混合气体的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol
令NO和NO2的物质的量分别为xmol、ymol,则:$\left\{\begin{array}{l}{x+y=0.5}\\{3x+y=1.02}\end{array}\right.$
解得x=0.26,y=0.24,
V(NO)=0.26mol×22.4L/mol=5.824L;V(NO2)=0.24mol×22.4L/mol=5.376L
答:NO的体积为5.824L;二氧化氮的体积为5.376L;
(2)由N原子守恒可知,反应消耗的硝酸为n(HNO3)=2n(Cu(NO3)2)+n(NOx)=0.51mol×2+0.5mol=1.52mol;
答:消耗的硝酸物质的量为1.52mol.
点评 本题考查化学方程式计算,难度不大,注意利用电子转移守恒和原子守恒进行解答,避免利用方程式计算的繁琐,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
2.NA为阿伏加德罗常数的值.下列说法中,正确的是( )
| A. | 常温常压下,5.6g Fe与足量Cl2充分反应转移电子总数为0.2NA | |
| B. | 密闭容器中2molNO与1molO2充分反应后,容器内气体的分子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| D. | 1 L 0.lmol•L-1的CH3COONa溶液中CH3COO-和CH3COOH粒子数之和为0.1NA |
6.在其他条件不变的情况下,能使合成氨反应进行程度增大的方法是( )
| A. | 升高温度 | B. | 减小压强 | C. | 使用催化剂 | D. | 及时分离出氨气 |
3.下列实验中,所采取的分离方法不正确的是( )
| 选项 | 目的 | 分离方法 |
| A | 除去铜器表面的铜绿【Cu2(OH)2CO3】 | 用盐酸浸泡,用清水冲洗 |
| B | 除去乙醇中的少量水 | 加生石灰,再蒸馏 |
| C | 除去 HCl中的 C12 | 通过饱和食盐水洗气再干燥 |
| D | 除去NaCl固 体中的 NH4Cl | 加热 |
| A. | A | B. | B | C. | C | D. | D |
4.下列属于弱电解质的是( )
| A. | CO2 | B. | BaSO4 | C. | HClO | D. | Cl2 |
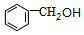 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O.
+H2O.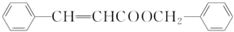 .
.