题目内容
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B,C形成电子总数为10的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数为18的气体分子.请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关);
(1)A~F六种元素原子,原子半径最大的是 (填元素符号),B元素在元素周期表中的位置 .
(2)D与E可形成化合物D2E,该化合物的晶体类型为 .
(3)A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与碳反应,该反应的化学方程式为 .
(4)比较E、F气态氢化物的稳定性: > (用分子式表示).
(5)请写出:CH3OH和O2与KOH溶液组成的燃料电池总反应式: .
(1)A~F六种元素原子,原子半径最大的是
(2)D与E可形成化合物D2E,该化合物的晶体类型为
(3)A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与碳反应,该反应的化学方程式为
(4)比较E、F气态氢化物的稳定性:
(5)请写出:CH3OH和O2与KOH溶液组成的燃料电池总反应式:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与C形成的化合物常温下为液态,该化合物为水,则A为H元素、C为O元素;A、B的最外层电子数之和与C的最外层电子数相等,B的最外层电子数为:6-1=5,B的原子序数小于O,则B为N元素;
A、D同主族,D的原子序数大于O,则D为Na元素;C与E同主族,则E为S元素;D、E、F同周期,A能分别与E、F形成电子总数为18的气体分子,则F为Cl元素,
根据以上分析可知:A为H元素、B为N元素、C为O元素、D为Na元素、E为S元素、F为Cl元素.
A、D同主族,D的原子序数大于O,则D为Na元素;C与E同主族,则E为S元素;D、E、F同周期,A能分别与E、F形成电子总数为18的气体分子,则F为Cl元素,
根据以上分析可知:A为H元素、B为N元素、C为O元素、D为Na元素、E为S元素、F为Cl元素.
解答:
解:A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与C形成的化合物常温下为液态,该化合物为水,则A为H元素、C为O元素;A、B的最外层电子数之和与C的最外层电子数相等,B的最外层电子数为:6-1=5,B的原子序数小于O,则B为N元素;
A、D同主族,D的原子序数大于O,则D为Na元素;C与E同主族,则E为S元素;D、E、F同周期,A能分别与E、F形成电子总数为18的气体分子,则F为Cl元素,
则:A为H元素、B为N元素、C为O元素、D为Na元素、E为S元素、F为Cl元素,
(1)同周期随原子序数增大,原子半径减小,最外层电子数相同,电子层越多原子半径越大,所以Na原子半径最大;
B为N元素,其原子序数为7,最外层为5个分子,含有2个电子层,位于周期表中第二周期VA族,
故答案为:Na;第二周期VA族;
(2)D为Na元素、E为S元素,D与E可形成化合物Na2S,硫化钠为离子化合物,其晶体类型为为离子晶体,故答案为:离子晶体;
(3)A为H元素,C为O元素,E为S元素;三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜反应,该化合物为H2SO4,该反应的化学方程式为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;
(4)E为S元素、F为Cl元素,非金属性越强,其氢化物越稳定,则二者氢化物稳定性大小为:HCl>H2S,故答案为:HCl;H2S;
(5)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池中,甲醇在碱性条件下失去电子生成碳酸钾,氧气得到电子,该燃料电池总反应为:2CH3OH+3O2+4KOH=2K2CO3+6H2O,故答案为:2CH3OH+3O2+4KOH=2K2CO3+6H2O.
A、D同主族,D的原子序数大于O,则D为Na元素;C与E同主族,则E为S元素;D、E、F同周期,A能分别与E、F形成电子总数为18的气体分子,则F为Cl元素,
则:A为H元素、B为N元素、C为O元素、D为Na元素、E为S元素、F为Cl元素,
(1)同周期随原子序数增大,原子半径减小,最外层电子数相同,电子层越多原子半径越大,所以Na原子半径最大;
B为N元素,其原子序数为7,最外层为5个分子,含有2个电子层,位于周期表中第二周期VA族,
故答案为:Na;第二周期VA族;
(2)D为Na元素、E为S元素,D与E可形成化合物Na2S,硫化钠为离子化合物,其晶体类型为为离子晶体,故答案为:离子晶体;
(3)A为H元素,C为O元素,E为S元素;三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜反应,该化合物为H2SO4,该反应的化学方程式为:C+2H2SO4(浓)
| ||
| ||
(4)E为S元素、F为Cl元素,非金属性越强,其氢化物越稳定,则二者氢化物稳定性大小为:HCl>H2S,故答案为:HCl;H2S;
(5)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池中,甲醇在碱性条件下失去电子生成碳酸钾,氧气得到电子,该燃料电池总反应为:2CH3OH+3O2+4KOH=2K2CO3+6H2O,故答案为:2CH3OH+3O2+4KOH=2K2CO3+6H2O.
点评:本题考查位置、结构、性质的关系及应用,综合性较强,考查知识点较多,元素的推断是解答本题的关键,A与C形成的化合物常温下为液态是推断突破口.并熟悉元素化合物的性质来解答,难度较大.

练习册系列答案
相关题目
解释下列现象的化学用语不正确的是( )
| A、向明矾溶液中滴加氢氧化钡溶液至SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+1AlO2-+2H2O |
| B、氢氧化镁白色沉淀溶于氯化铵溶液:Mg(OH)2+2NH4+=Mg2++2NH3?H2O |
| C、磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-=3Fe3++NO↑+4H2O |
| D、漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀:Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO |
闪电时空气中的N2和O2会发生反应:N2(g)+2O2(g)═2NO2(g)△H=+180.50kJ/mol,△S=247.3J/(mol?K),若不考虑温度对该反应焓变的影响,则下列说法中正确的是( )
| A、在1 000℃时,此反应能自发进行 |
| B、在1 000℃时,此反应不能自发进行 |
| C、该反应能自发进行的最低温度约为730℃ |
| D、该反应能自发进行的最高温度约为730 K |
 ;
;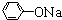 +RCl→NaCl+
+RCl→NaCl+