题目内容
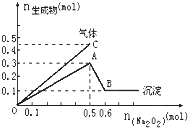 向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中Mg2+、NH4+、Al3+三种离子的物质的量之比为( )
向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中Mg2+、NH4+、Al3+三种离子的物质的量之比为( )| A、1:1:2 |
| B、2:2:1 |
| C、1:2:2 |
| D、9:2:4 |
考点:离子方程式的有关计算
专题:计算题
分析:根据图象分析,A点时沉淀的量最大,所以沉淀是氢氧化铝和氢氧化镁,从A点到B点,沉淀的质量减少,减少的量是氢氧化铝,为0.2mol,沉淀不溶解的量是氢氧化镁,物质的量是0.1mol,根据原子守恒确定镁离子、铝离子的物质的量;当沉淀的量最大时,根据过氧化钠的物质的量计算生成氧气的物质的量,根据气体总的物质的量计算生成氨气的物质的量,根据氮原子守恒从而计算铵根离子的物质的量.
解答:
解:由图知,沉淀中含0.1mol Mg(OH)2和0.2mol Al(OH)3,即原溶液中含Mg2+0.1mol,含Al3+0.2mol,Mg2++2OH-=Mg(OH)2↓,Al3++3OH-=Al(OH)3↓沉淀2种金属阳离子共需NaOH的物质的量为0.1×2+0.2×3=0.8mol.由图中横坐标知与3种阳离子恰好完全反应时需Na2O20.5mol,而0.5molNa2O2与水反应生成1molNaOH和0.25molO2,由NH4++OH-=NH3+H2O,所以NH4+消耗NaOH的量或生成NH3的体积均可求得原溶液中含0.2molNH4+,所以Mg2+、NH4+、Al3+之比=0.1mol:0.2mol:0.2mol=1:2:2,
故选C.
故选C.
点评:本题考查了煤、铝离子的有关计算,难度较大,能正确分析图片中各微粒之间的关系是解本题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是(设NA表示阿伏加德罗常数的值)( )
| A、25℃时,1L pH=1 的硫酸溶液中,含有0.2NA个H+ |
| B、4.6gNa 完全转化成Na2O 和Na2O2的混合物,生成物中阴离子总数为0.1 NA |
| C、标准状况下,2.24LSO3溶于1L 水,得到溶液的浓度为1 mol?L-1 |
| D、300mL 2 mol?L-1蔗糖溶液中所含分子数为0.6NA |
类推是中学化学学习中一种重要的思维方法.下列类推结论正确的是( )
| A、CO2能使苯酚钠溶液变浑浊,稀HCl也能使苯酚钠溶液变浑浊 |
| B、NH4HCO3溶液呈碱性,NH4HSO4溶液也呈碱性 |
| C、CaCO3与稀硝酸反应生成CO2,CaSO3与稀硝酸反应生成SO2 |
| D、常温下,Al在浓硫酸中无明显变化,Mg在浓硫酸中也无明显变化 |
下列实验事实不能用勒夏特列原理解释的是( )
| A、实验室用排饱和食盐水的方法收集氯气 |
| B、打开汽水瓶时,瓶中立即泛起大量泡沫 |
C、 |
D、 |
下列物质燃烧热相同的是( )
| A、1mol C2H40.5mol C4H8 |
| B、2mol正丁烷 2mol异丁烷 |
| C、1mol 金刚石 12g石墨 |
| D、3mol乙醇 2mo乙醇 |
同温同压下,两个体积相同的容器,一个盛有CO,另一个盛有O2、H2的混合气体,两瓶中气体一定具有相同的( )
| A、质量 | B、电子总数 |
| C、原子总数 | D、密度 |
下列实验方案与现象能说明溶液中一定大量存在相应离子的是( )
A、NH4+:试液
| |||||
B、I-:试液
| |||||
C、HCO3-:试液
| |||||
D、Fe2+:试液
|
下列物质中既能与盐酸反应又能与NaOH溶液反应的是( )
①Al2O3 ②Al(OH)3 ③NH4NO3 ④Na2CO3 ⑤NaHCO3 ⑥(NH4)2CO3 ⑦MgO ⑧Mg(OH)2.
①Al2O3 ②Al(OH)3 ③NH4NO3 ④Na2CO3 ⑤NaHCO3 ⑥(NH4)2CO3 ⑦MgO ⑧Mg(OH)2.
| A、①②⑦⑧ | B、①②④⑤ |
| C、①②⑤⑥ | D、③⑥⑦⑧ |
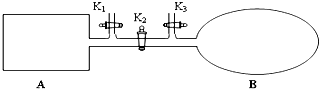 如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,将各1mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L.
如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,将各1mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L.