题目内容
下列说法正确的是(设NA表示阿伏加德罗常数的值)( )
| A、25℃时,1L pH=1 的硫酸溶液中,含有0.2NA个H+ |
| B、4.6gNa 完全转化成Na2O 和Na2O2的混合物,生成物中阴离子总数为0.1 NA |
| C、标准状况下,2.24LSO3溶于1L 水,得到溶液的浓度为1 mol?L-1 |
| D、300mL 2 mol?L-1蔗糖溶液中所含分子数为0.6NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.根据溶液的pH计算出氢离子的浓度,再计算出氢离子的物质的量及数目;
B.钠为1价金属,4.6g钠的物质的量为0.2mol,完全反应生成0.1mol氧化钠和过氧化钠的混合物,过氧化钠中阴离子为过氧根离子,则0.1mol混合物中含有0.1mol阴离子;
C.标况下三氧化硫的状态不是气体,且溶于1L水中,溶液的体积不是1L;
D.蔗糖溶液中含有蔗糖分子和水分子,漏掉了水分子.
B.钠为1价金属,4.6g钠的物质的量为0.2mol,完全反应生成0.1mol氧化钠和过氧化钠的混合物,过氧化钠中阴离子为过氧根离子,则0.1mol混合物中含有0.1mol阴离子;
C.标况下三氧化硫的状态不是气体,且溶于1L水中,溶液的体积不是1L;
D.蔗糖溶液中含有蔗糖分子和水分子,漏掉了水分子.
解答:
解:A.1 L pH=1的硫酸溶液中,氢离子浓度为0.1mol/L,1L该硫酸溶液中含有0.1mol氢离子,含有的H+数为0.1NA,故A错误;
B.4.6g Na物质的量为0.2mol,完全转化成Na2O和Na2O2的混合物,氧化钠是由钠离子和氧离子,过氧化钠由钠离子和过氧根离子构成,生成物中阴离子总数为0.1 NA,故B正确;
C.标准状况下,三氧化硫不是气体,且三氧化硫溶于1L水中,所得溶液的体积也不是1L,无法计算溶液的浓度,故C错误;
D.300mL 2 mol?L-1蔗糖溶液中含有蔗糖0.6mol,溶液中还含有水分子,则溶液中含有的分子的物质的量大于0.6mol,所含分子数大于0.6NA,故D错误;
故选B.
B.4.6g Na物质的量为0.2mol,完全转化成Na2O和Na2O2的混合物,氧化钠是由钠离子和氧离子,过氧化钠由钠离子和过氧根离子构成,生成物中阴离子总数为0.1 NA,故B正确;
C.标准状况下,三氧化硫不是气体,且三氧化硫溶于1L水中,所得溶液的体积也不是1L,无法计算溶液的浓度,故C错误;
D.300mL 2 mol?L-1蔗糖溶液中含有蔗糖0.6mol,溶液中还含有水分子,则溶液中含有的分子的物质的量大于0.6mol,所含分子数大于0.6NA,故D错误;
故选B.
点评:本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件,选项D为易错点,注意蔗糖溶液中还含有水分子.

练习册系列答案
相关题目
制备金属氯化物,常用两种方法:①用金属与氯气直接化合得到;②用金属与盐酸反应制得.下列氯化物中既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是( )
| A、CuCl2 |
| B、FeCl3 |
| C、AlCl3 |
| D、FeCl2 |
某原子核外电子排布式为ns2np7,它违背了( )
| A、泡利原理 |
| B、能量最低原理 |
| C、洪特规则 |
| D、洪特规则特例 |
家用管道煤气的主要成分是CO、H2、CH4,取1L管道煤气充分燃烧需要同温同压下的空气5L(氧气的体积分数为20%),则CO、H2、CH4的体积比不可能是( )
| A、1:1:1 |
| B、1:1:2 |
| C、2:4:3 |
| D、1:3:2 |
用NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
| A、标准状况下,22.4LCO2含有的分子数为0.1NA |
| B、等物质的量的N2和CO所含分子数均为NA |
| C、标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g |
| D、3.8gNH4中含有的H原子数为0.2NA |
下列关于溶液和胶体的叙述中,正确的是( )
| A、胶体带电荷,而溶液呈电中性 |
| B、胶体加入电解质溶液可产生沉淀,而溶液不能 |
| C、胶体是一种介稳性的分散系,而溶液是一种非常稳定的分散系 |
| D、胶体和溶液都能产生丁达尔现象 |
在容量瓶上,下列标记不存在的是( )
| A、标线 | B、温度 |
| C、浓度 | D、容量规格 |
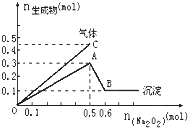 向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中Mg2+、NH4+、Al3+三种离子的物质的量之比为( )
向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中Mg2+、NH4+、Al3+三种离子的物质的量之比为( )| A、1:1:2 |
| B、2:2:1 |
| C、1:2:2 |
| D、9:2:4 |