题目内容
类推是中学化学学习中一种重要的思维方法.下列类推结论正确的是( )
| A、CO2能使苯酚钠溶液变浑浊,稀HCl也能使苯酚钠溶液变浑浊 |
| B、NH4HCO3溶液呈碱性,NH4HSO4溶液也呈碱性 |
| C、CaCO3与稀硝酸反应生成CO2,CaSO3与稀硝酸反应生成SO2 |
| D、常温下,Al在浓硫酸中无明显变化,Mg在浓硫酸中也无明显变化 |
考点:苯酚的化学性质,铵盐,硝酸的化学性质,铝的化学性质
专题:
分析:A、化学反应符合强酸制弱酸的原理:碳酸、盐酸的酸性均比苯酚的酸性强;
B、NH4HCO3为弱碱弱酸盐,水解呈碱性,NH4HSO4溶液中存在大量的氢离子;
C、亚硫酸钙与稀硝酸发生氧化还原反应;
D、常温下遇到浓硫酸、浓硝酸会发生钝化的金属:铁和铝.
B、NH4HCO3为弱碱弱酸盐,水解呈碱性,NH4HSO4溶液中存在大量的氢离子;
C、亚硫酸钙与稀硝酸发生氧化还原反应;
D、常温下遇到浓硫酸、浓硝酸会发生钝化的金属:铁和铝.
解答:
解:A、碳酸、盐酸的酸性均比苯酚的酸性强,CO2能使苯酚钠溶液变浑浊,稀HCl也能使苯酚钠溶液变浑浊,符合强酸制弱酸的原理,故A正确;
B、NH4HCO3溶液为弱碱弱酸盐,水解呈碱性,NH4HSO4溶液因为能电离出大量的氢离子而显示酸性,故B错误;
C、CaSO3与稀硝酸反应生成硫酸钙、一氧化氮和水,故C错误;
D、常温下,Al在浓硫酸中因为钝化而无明显变化,但是金属镁可以和浓硫酸发生氧化还原反应,故D错误.
故选A.
B、NH4HCO3溶液为弱碱弱酸盐,水解呈碱性,NH4HSO4溶液因为能电离出大量的氢离子而显示酸性,故B错误;
C、CaSO3与稀硝酸反应生成硫酸钙、一氧化氮和水,故C错误;
D、常温下,Al在浓硫酸中因为钝化而无明显变化,但是金属镁可以和浓硫酸发生氧化还原反应,故D错误.
故选A.
点评:本题考查类比方法的应用,题目难度不大,解答该题的关键是把握相关物质的性质.

练习册系列答案
相关题目
某原子核外电子排布式为ns2np7,它违背了( )
| A、泡利原理 |
| B、能量最低原理 |
| C、洪特规则 |
| D、洪特规则特例 |
下列关于溶液和胶体的叙述中,正确的是( )
| A、胶体带电荷,而溶液呈电中性 |
| B、胶体加入电解质溶液可产生沉淀,而溶液不能 |
| C、胶体是一种介稳性的分散系,而溶液是一种非常稳定的分散系 |
| D、胶体和溶液都能产生丁达尔现象 |
在容量瓶上,下列标记不存在的是( )
| A、标线 | B、温度 |
| C、浓度 | D、容量规格 |
下列氧化物不能与铝粉组成铝热剂的是( )
| A、Cr2O3 |
| B、MnO2 |
| C、V2O5 |
| D、MgO |
卤素单质从F2到I2在常温常压下的聚集状态由气态、液态到固态的原因是( )
| A、原子间的化学键键能逐渐减小 |
| B、范德华力逐渐增大 |
| C、原子半径逐渐增大 |
| D、氧化性逐渐减弱 |
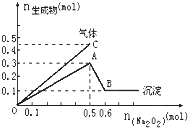 向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中Mg2+、NH4+、Al3+三种离子的物质的量之比为( )
向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中Mg2+、NH4+、Al3+三种离子的物质的量之比为( )| A、1:1:2 |
| B、2:2:1 |
| C、1:2:2 |
| D、9:2:4 |
