题目内容
13.氯化硫(S2Cl2)的结构式为Cl-S-S-Cl,常温下为浅黄色油状液体,遇与水即分解:2S2Cl2+2H2O→4HCl+SO2↑+3S↓.下列有关此反应的说法正确的是( )| A. | S2Cl2做氧化剂,H2O做还原剂 | |
| B. | 每生成l mol SO2转移4 mol电子 | |
| C. | 氧化产物与还原产物的物质的量之比为l:3 | |
| D. | 每生成48g硫会断裂2mol氢氧键 |
分析 反应2S2Cl2+2H2O=4HCl+SO2↑+3S↓中,S元素的化合价由+1价升高为+4价,S元素的化合价由+1价降低为0,以此对各选项进行判断.
解答 解:A.只有S元素的化合价变化,则S2Cl2既作氧化剂又作还原剂,故A错误;
B.S元素的化合价由+1价升高为+4价,则每生成1molSO2转移3mol电子,故B正确;
C.S元素的化合价由+1价升高为+4价,氧化产物是二氧化硫,还原产物是单质硫,氧化产物与还原产物的物质的量之比为l:3,故C正确;
D.48gS的物质的量为:$\frac{48g}{32g/mol}$=1.5mol,根据反应可知,生成1.5molS,1mol水分子中含有2mol共价键,所以每生成48g硫会断裂2mol共价键,故D正确;
故选CD.
点评 本题考查氧化还原反应的应用,为高频考点,题目难度中等,明确反应中元素的化合价变化为解答的关键,试题侧重分析与应用能力的考查.

练习册系列答案
相关题目
3.下列叙述正确的是( )
| A. | 1H和2H是不同的核素,它们的中子数相同 | |
| B. | 6Li和7Li的质子数相等,电子数也相等 | |
| C. | 14C和14N的质子数不等,它们的中子数相等 | |
| D. | 13C和14C属于同一种元素,它们的质量数相等 |
4.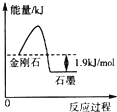 根据表中的信息判断下列说法错误的是( )
根据表中的信息判断下列说法错误的是( )
 根据表中的信息判断下列说法错误的是( )
根据表中的信息判断下列说法错误的是( )| 物质 | 外观 | 燃烧热/(kJ•mol-1) |
| 金刚石 | 无色、透明固体 | 395.4 |
| 石墨 | 灰黑,不透明固体 | 393.5 |
| A. | 由表中信息可得如图所示的图象 | |
| B. | 由表中信息知C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•mol-1 | |
| C. | 由表中信息可知相同条件下金刚石的熔点低于石墨的熔点 | |
| D. | 石墨燃烧热的热化学方程式为C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H=-393.5 kJ•mol-1 |
1.下列说法不能用元素周期律解释的是( )
| A. | 浓硝酸的氧化性强于稀硝酸 | |
| B. | 与冷水反应的速率:Na>Mg | |
| C. | 向淀粉KI溶液中滴入溴水,溶液变蓝 | |
| D. | 原子半径:Al>Si>P |
8.一种塑料抗氧化剂C可通过下列反应合成:
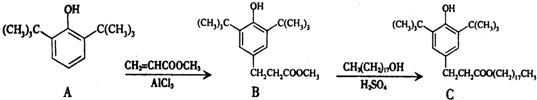
下列有关叙述正确的是( )

下列有关叙述正确的是( )
| A. | 物质A是苯甲醇的同系物 | |
| B. | 物质B能发生取代、加聚等反应 | |
| C. | 可用氯化铁溶液鉴别物质C中是否含有CH3(CH2)17OH杂质 | |
| D. | 1 mol物质C与足量NaOH溶液反应,最多可消耗2 mol NaOH |
3.下列说法正确的是( )
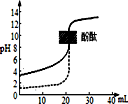

| A. | 反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)在室温下可自发进行,则该反应的△H<0 | |
| B. | 在铜的电解精炼过程中,若转移1mol电子,则阳极溶解32gCu | |
| C. | 常温下向CuS的悬浊液中加入饱和MnSO4溶液可生成MnS沉淀,则Ksp(MnS))<Ksp(CuS) | |
| D. | 常温下用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线(如图)表示的是滴定盐酸的曲线 |
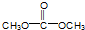 简称DMC)是油漆、胶粘剂行业的环保型绿色溶剂.DMC的合成方法很多,如以乙烯为原料,与甲醇进行酯交换的合成路线如下:
简称DMC)是油漆、胶粘剂行业的环保型绿色溶剂.DMC的合成方法很多,如以乙烯为原料,与甲醇进行酯交换的合成路线如下: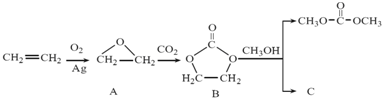

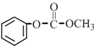 ;
;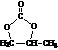 的合成路线(注明必要的反应条件)
的合成路线(注明必要的反应条件)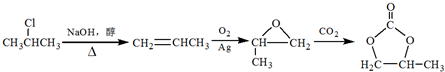 .合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物.
.合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物.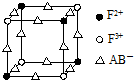 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子. .
.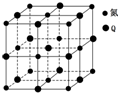 X、Y、Z、Q、R五种元素的原子序数依次增大.其中:X的最外层电子排布为nsnnp2n;Y是元素周期表中电负性最大的元素;Y、Z位于同一主族;Q基态原子核外的M能层中有两个未成对电子和三个空轨道;R位于第四周期ⅥB族.
X、Y、Z、Q、R五种元素的原子序数依次增大.其中:X的最外层电子排布为nsnnp2n;Y是元素周期表中电负性最大的元素;Y、Z位于同一主族;Q基态原子核外的M能层中有两个未成对电子和三个空轨道;R位于第四周期ⅥB族.