题目内容
2. X、Y、Z、Q、R五种元素的原子序数依次增大.其中:X的最外层电子排布为nsnnp2n;Y是元素周期表中电负性最大的元素;Y、Z位于同一主族;Q基态原子核外的M能层中有两个未成对电子和三个空轨道;R位于第四周期ⅥB族.
X、Y、Z、Q、R五种元素的原子序数依次增大.其中:X的最外层电子排布为nsnnp2n;Y是元素周期表中电负性最大的元素;Y、Z位于同一主族;Q基态原子核外的M能层中有两个未成对电子和三个空轨道;R位于第四周期ⅥB族.请回答下列问题:
(1)R元素基态原子的电子排布式为1s22s22p63s23p63d54s1,它的最高价氧化物的水化物的化学式为H2Cr2O7
(2)XY2分子的立体构型是V形,中心原子的杂化方式是sp3.
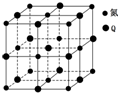
(3)Q与氮元素形成的一种化合物晶胞如图所示,该化合物的化学式为NiN.该晶体中与氮原子距离相等且最近的氮原子有12个.
(4)化合物QZ4熔点为37℃,沸点为136℃,熔融态不导电,可知QZ4的晶体类型是分子晶体.QZ4与热水反应的化学方程式为TiCl4+(x+2)H2O=TiO2•xH2O↓+4HCl.
分析 X、Y、Z、Q、R五种元素的原子序数依次增大.X的最外层电子排布为nsnnp2n,由于n=2,故X为S元素;R位于第四周期ⅥB族,则R为Cr元素;Q基态原子核外的M能层中有两个未成对电子和三个空轨道,故核外电子排布式为1s22s22p63s23p63d24s2,故Q为Ti;Y是元素周期表中电负性最大的元素,则Y为F元素;Y、Z位于同一主族,Z的原子序数小于Cr,故Z为Cl.
(1)R位于第四周期ⅥB族,外围电子排布式为3d54s1,最高正化合价为+6;
(2)SF2分子中S原子孤电子对=$\frac{6-1×2}{2}$=2,价层电子对数=2+2=4,杂化轨道数目为4;
(3)根据均摊法计算晶胞中N、Ti原子数目,进而确定化学式;以顶点N原子研究,与之距离最近的N原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用;
(4)化合物QZ4熔点为37℃,沸点为136℃,熔沸点低,熔融态不导电,可知QZ4的晶体类型是分子晶体,TiCl4与热水反应TiO2•xH2O与HCl.
解答 解:X、Y、Z、Q、R五种元素的原子序数依次增大.X的最外层电子排布为nsnnp2n,由于n=2,故X为S元素;R位于第四周期ⅥB族,则R为Cr元素;Q基态原子核外的M能层中有两个未成对电子和三个空轨道,故核外电子排布式为1s22s22p63s23p63d24s2,故Q为Ti;Y是元素周期表中电负性最大的元素,则Y为F元素;Y、Z位于同一主族,Z的原子序数小于Cr,故Z为Cl.
(1)R位于第四周期ⅥB族,基态原子的电子排布式为1s22s22p63s23p63d54s1,外围电子排布式为3d54s1,最高正化合价为+6,最高价氧化物的水化物为H2Cr2O7,
故答案为:1s22s22p63s23p63d54s1;H2Cr2O7;
(2)SF2分子中S原子孤电子对=$\frac{6-1×2}{2}$=2,价层电子对数=2+2=4,为V形结构,杂化轨道数目为4,S原子采取sp3杂化,
故答案为:V形;sp3;
(3)晶胞中N原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、Ti原子数目=1+12×$\frac{1}{4}$=4,故化学式为NiN;以顶点N原子研究,与之距离最近的N原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,即晶体中与氮原子距离相等且最近的氮原子有$\frac{8×3}{2}$=12 个,
故答案为:NiN;12;
(4)化合物QZ4熔点为37℃,沸点为136℃,熔沸点低,熔融态不导电,可知QZ4的晶体类型是分子晶体,TiCl4与热水反应TiO2•xH2O与HCl,反应方程式为:TiCl4+(x+2)H2O=TiO2•xH2O↓+4HCl,
故答案为:分子晶体;TiCl4+(x+2)H2O=TiO2•xH2O↓+4HCl.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、空间构型与杂化方式、晶胞计算、晶体类型与性质等,掌握均摊法进行晶胞有关计算,(4)中方程式的书写为易错点、难点,中学不涉及Ti元素化合物知识.

 阅读快车系列答案
阅读快车系列答案| A. | 生物柴油具有良好的燃料性能,属于烃类,安全、环保、可再生 | |
| B. | 油脂是人类维持生命活动所需能量的主要来源 | |
| C. | PM2.5是指空气中氮氧化物和硫氧化物含量之和 | |
| D. | 登高山时防晒是为了防止强紫外线引起皮肤蛋白质被灼伤变性 |
| A. | S2Cl2做氧化剂,H2O做还原剂 | |
| B. | 每生成l mol SO2转移4 mol电子 | |
| C. | 氧化产物与还原产物的物质的量之比为l:3 | |
| D. | 每生成48g硫会断裂2mol氢氧键 |
| A. | 我国居民传统膳食以糖类为主,淀粉、脂肪都是糖类物质 | |
| B. | 人体内的蛋白质不断分解,最终生成水和二氧化碳排出体外 | |
| C. | 长期烧水的水壶内壁容易形成一层水垢,可以用食醋除去 | |
| D. | 明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用 |
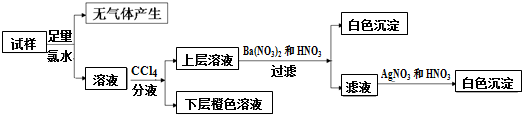
| A. | 若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响 | |
| B. | 无法确定原溶液中是否存在Cl- | |
| C. | 肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定 | |
| D. | 肯定不存在的离子是Mg2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证 |
| A. | CH3CH(CH2CH3)2的系统命名为3-甲基戊烷,与CH3CH2CH(CH3)CH2CH3互为同系物 | |
| B. | 乙烯、氯乙烯和聚氯乙烯都能因发生加成反应而使溴水褪色 | |
| C. | 用甘氨酸(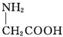 )和丙氨酸( )和丙氨酸(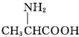 )的混合物在一定条件下可形成四种链状二肽 )的混合物在一定条件下可形成四种链状二肽 | |
| D. | 甲苯(C7H8)和甘油(C3H8O3)混合物,当总质量一定时,随$\frac{n({C}_{7}{H}_{8})}{n({C}_{3}{H}_{8}{O}_{3})}$比值增大,耗氧量和生成水的量都增大. |
(1)依据题给条件.你认为他们能完成哪些因素对速率形响的探究?HNO3浓度、温度、大理石的表面积.
(2)请根据(I)中选择的探究内容.填写以下实验设计表.完成探究实验:
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 常温 | 2.00 | |
| ② | 1.00 | ||
| ③ | 2.00 | ||
| ④ | 2.00 |
 (3)整个实验中应控制的不变量是硝酸溶液体积和CaCO3质量.
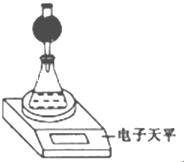
(3)整个实验中应控制的不变量是硝酸溶液体积和CaCO3质量.(4)该实验小组用如图实验装置进行实验.
①除电于天平、干燥管、锥形瓶、药匙、胶塞等仪器外.必需的实验仪器还有量筒、秒表.干燥管中放置的试剂可以是bc(填序号).
a.碱石灰 b.无水CaCl2 c.P2O5固体 d.浓硫酸
③若撤除干燥管装置,所测速率偏大(填“偏大”“偏小”或“不变”).
